Les malformations congénitales du fœtus occupent la 2e à la 3e place dans la structure des causes de décès périnatal du fœtus et du nouveau-né. D'une grande importance diagnostic précoce malformations, qui est nécessaire pour résoudre en temps opportun la question de la possibilité de prolonger la grossesse, qui est déterminée par le type de défaut, la compatibilité avec la vie et le pronostic du développement postnatal. Selon l'étiologie, on distingue les malformations congénitales héréditaires (génétiques), exogènes et multifactorielles du fœtus. Héréditaire comprennent les malformations résultant de mutations, c'est-à-dire changements persistants dans les structures héréditaires des gamètes ou du zygote. Selon le niveau auquel la mutation s'est produite (gènes ou chromosomes), on distingue les syndromes monogéniques et les maladies chromosomiques. Les défauts exogènes comprennent les défauts causés par l'effet néfaste de facteurs exogènes. Ces facteurs, agissant pendant la période de gamétogenèse ou de grossesse, conduisent à la survenue de malformations congénitales sans perturber la structure de l'appareil héréditaire.
Les malformations d'origine multifactorielle sont appelées défauts apparus sous l'influence combinée de facteurs génétiques et exogènes. Il existe également des défauts isolés (localisés dans un organe), systémiques (au sein d'un système organique) et multiples (dans les organes de deux systèmes ou plus).
DÉFAUTS DU SYSTÈME NERVEUX CENTRAL
Classement des malformations les plus courantes du système nerveux central :
1. Hydrocéphalie :
Sténose de l'aqueduc cérébral;
Hydrocéphalie ouverte ;
Syndrome de Dandy-Walker.
2. Papillome du plexus choroïde.
3. Anomalies du tube neural :
- spina bifida;
anencéphalie ;
Céphalocèle.
4. Microcéphalie. Hydrocéphalie
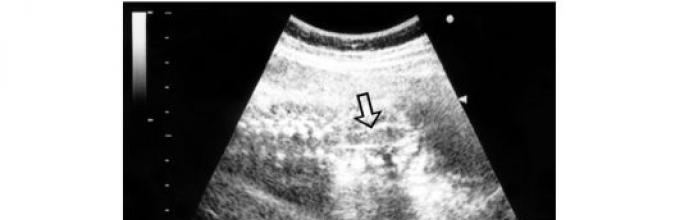
Hydrocéphalie- une augmentation de la taille des ventricules du cerveau avec une augmentation simultanée de la pression intracrânienne, accompagnée dans la plupart des cas d'une augmentation de la taille de la tête (Fig. 28).
Riz. 28. Image échographique d'hydrocéphalie fœtale sévère (les flèches indiquent des ventricules cérébraux fortement dilatés, dont le cortex est considérablement aminci, la taille de la tête fœtale dépasse les valeurs normales pour un âge gestationnel donné)
La ventriculomégalie est une augmentation isolée de la taille des ventricules, non accompagnée d'une augmentation de la taille de la tête. L'hydrocéphalie est observée avec une fréquence de 0,1 à 2,5 pour 1000 nouveau-nés. Environ 60 % des fœtus atteints d'hydrocéphalie sont des garçons. L'hydrocéphalie peut être le résultat de nombreuses maladies d'étiologies diverses. Dans la plupart des cas, il se développe à la suite d'une violation de l'écoulement du liquide céphalo-rachidien. La forme communicante de l'hydrocéphalie est causée par une
obstruction culaire, tandis que la forme obstructive est une obstruction intraventriculaire. Parfois, l'hydrocéphalie entraîne une augmentation de la production de liquide céphalo-rachidien (par exemple, dans le contexte du papillome des plexus vasculaires) ou une violation de sa réabsorption dans l'espace sous-arachnoïdien.
Des anomalies extracrâniennes dans l'hydrocéphalie surviennent dans 63 % des cas : agénésie et dysplasie des reins, communication interventriculaire, tétralogie de Fallot, méningomyélocèle, dédoublement la lèvre supérieure, palais mou et dur, atrésie de l'anus et du rectum, dysgénésie gonadique. L'hydrocéphalie est représentée principalement par une sténose de l'aqueduc cérébral (rétrécissement de l'aqueduc sylvien) ; hydrocéphalie ouverte (expansion des ventricules du cerveau et du système sous-arachnoïdien du cerveau à la suite de l'obstruction du système extraventriculaire des voies d'écoulement du liquide céphalo-rachidien); Syndrome de Dandy-Walker (association d'hydrocéphalie, de kystes de la fosse crânienne postérieure, de défauts du vermis cérébelleux, à travers lesquels le kyste communique avec la cavité du ventricule IV). Lorsqu'une hydrocéphalie est détectée, l'anatomie des structures cérébrales, ainsi que la colonne vertébrale, doivent être soigneusement évaluées pour exclure spina bifida. Un examen complet du fœtus devrait inclure un examen échocardiographique, car l'hydrocéphalie est souvent associée à des malformations cardiaques congénitales. Avec l'hydrocéphalie avant la période de viabilité fœtale, il est conseillé de discuter de la question de l'interruption de grossesse avec les parents. Lors de la prolongation de la grossesse, une surveillance échographique dynamique est affichée toutes les 2 semaines. Avec une augmentation de l'hydrocéphalie à l'atteinte de la maturité des poumons du fœtus, la question de l'accouchement précoce et du shunt doit être posée. L'efficacité du pontage ventriculaire prénatal n'a pas encore été prouvée et cette opération est peu utilisée. La césarienne n'est indiquée qu'en cas de macrocéphalie sévère et en l'absence d'autres malformations. En présence d'anomalies macroscopiques combinées qui aggravent le pronostic vital, l'opération de choix est la céphalocentèse.
Anomalies du tube neural. Ce terme comprend l'anencéphalie, le céphalocèle et spina bifida.
spina bifida- une anomalie dans le développement de la colonne vertébrale, résultant d'une violation du processus de fermeture du tube neural (Fig. 29).
La sortie par un défaut des membranes de la moelle épinière est appelée méningocèle. Si le sac herniaire contient du tissu nerveux, la formation
 Riz. 29. Image échographique spina bifida dans la colonne lombo-sacrée (marquée d'une flèche)
Riz. 29. Image échographique spina bifida dans la colonne lombo-sacrée (marquée d'une flèche)
est appelée méningomyélocèle. Distinguer spina bifida kystique(forme kystique de hernie rachidienne avec formation d'un sac herniaire contenant les membranes du cerveau et/ou la substance du cerveau) et spina bifida occulte(forme cachée, qui ne s'accompagne pas de la formation d'une saillie herniaire). Le plus souvent, ce défaut est localisé dans la colonne lombaire et sacrée. Fréquence d'occurrence spina bifida dépend de la zone géographique. Dans certaines régions du Royaume-Uni, la fréquence de ce défaut est de 4 pour 1000 nouveau-nés. Aux États-Unis, ce chiffre est de 0,5 pour 1000, bien que cela dépende des caractéristiques raciales et géographiques. spina bifida- une malformation qui survient en raison d'une violation de la fermeture du tube neural à la 4ème semaine de développement embryonnaire. Cette anomalie est héritée de manière multifactorielle. spina bifide a peut se former à la suite d'une hyperthermie maternelle, si elle souffre de diabète sucré, d'une exposition à des facteurs tératogènes, et également faire partie de syndromes génétiques (avec un gène mutant isolé) ou d'anomalies chromosomiques (trisomie de 13 et 18 paires de chromosomes, triploïdie , translocation déséquilibrée ou chromosome en anneau). La hernie vertébrale est associée à plus
plus de 40 syndromes de malformations multiples (hydrocéphalie, malformations cardiaques congénitales et système génito-urinaire).
L'examen prénatal comprend la détermination du caryotype et une échographie approfondie. Attention particulière doit être donnée à l'anatomie de la tête, du cœur, des bras et des jambes. Si une méningomyélocèle est détectée avant la viabilité du fœtus, la femme doit se voir proposer une interruption médicale de grossesse. Lors de la prolongation de la grossesse, une échographie dynamique est indiquée toutes les 2 à 3 semaines pour évaluer l'apparition d'autres signes (par exemple, la ventriculomégalie). Les parents doivent recevoir une consultation avec un neurochirurgien pour discuter des possibilités d'intervention chirurgicale après l'accouchement (fermeture du défaut ou pontage), ainsi que du pronostic pour la vie et la santé de l'enfant. L'accouchement doit être effectué dans les grands centres périnataux dès que les poumons du fœtus atteignent une maturité suffisante. Risque empirique de récidive spina-bibida est de 3 à 5 %. L'utilisation de fortes doses d'acide folique (4 mg), commencée 3 mois avant la grossesse prévue et poursuivie pendant la première moitié de celle-ci, peut réduire considérablement le risque d'anomalie.
Toute anomalie ouverte du tube neural doit être fermée dans les 24 premières heures de vie. Un traitement antibactérien commencé immédiatement après la naissance peut réduire le risque de complications infectieuses. Le pronostic vital et sanitaire dépend du niveau de localisation de la méningomyélocèle, ainsi que du nombre et de la nature des anomalies associées. développement mental les enfants qui ont un tour de tête normal et un cerveau bien formé à la naissance ne souffrent pas. Les patients atteints de méningomyélocèle situés en L2 et au-dessus sont presque toujours contraints d'utiliser un fauteuil roulant.
Anencéphalie(pseudocéphalie, dysencéphalie extracrânienne) - l'absence des hémisphères cérébraux et de la majeure partie de la voûte crânienne, alors qu'il existe un défaut dans l'os frontal au-dessus de la région supraorbitaire, le temporal et une partie de l'os occipital sont absents. La partie supérieure de la tête est recouverte d'une membrane vasculaire. Les structures du mésencéphale et du diencéphale sont partiellement ou complètement détruites. L'hypophyse et la fosse rhomboïde sont majoritairement préservées. Les manifestations typiques comprennent des yeux exorbités, une grande langue et un cou court. Cette pathologie survient avec une fréquence de 1 sur 1000. Plus souvent elle
trouvé chez les filles nouveau-nées. Acranie(exencéphalie) - l'absence de la voûte crânienne en présence d'un fragment de tissu cérébral. C'est une pathologie plus rare que l'anencéphalie. L'anencéphalie est le résultat de l'échec de la fermeture du neuropore rostral dans les 28 jours suivant la fécondation. Hérédité multifactorielle et autosomique récessive, des anomalies chromosomiques sont notées. Les facteurs de risque comprennent le diabète maternel. Dans des expériences sur des animaux, la tératogénicité des radiations, des salicylates, des sulfamides et des niveaux élevés de dioxyde de carbone a été établie. Le diagnostic échographique peut être établi dès 12-13 semaines de grossesse. L'anencéphalie et l'acranie sont des malformations absolument mortelles, par conséquent, dans les deux cas, la femme doit se voir proposer une interruption de grossesse. Tous les nouveau-nés atteints d'anencéphalie et d'acranie meurent dans les 2 semaines suivant la naissance. Le risque empirique de récidive de l'anencéphalie est de 3 à 5 %. L'utilisation de fortes doses d'acide folique (4 mg), commencée 3 mois avant la grossesse prévue et poursuivie pendant la première moitié de celle-ci, peut réduire considérablement le risque d'anomalie.
Céphalocèle(encéphalocèle, méningocèle crânienne ou occipitale, division du crâne) - renflement du contenu du crâne par un défaut osseux. Le terme "méningocèle crânien" désigne la saillie uniquement à travers le défaut des membranes méningées. Lorsque le tissu cérébral se trouve dans le sac herniaire, le terme "encéphalocèle" est utilisé. La céphalocèle est rare (1:2000 naissances vivantes) et est une composante de nombreux syndromes génétiques (syndromes de Meckele, dédoublement médian du visage) et non génétiques (constriction amniotique). Le céphalocèle se développe à la suite de la non-fermeture d'une anomalie du tube neural et survient à la 4ème semaine de développement. Un défaut dans le crâne, à travers lequel les membranes du cerveau et du tissu cérébral peuvent prolapsus, se forme à la suite de la non-séparation de l'ectoderme de surface et du neuroectoderme sous-jacent. Si un céphalocèle est détecté, la femme doit se voir proposer une interruption médicale de grossesse. Lors de la prolongation de la grossesse, la tactique d'accouchement dépend de la taille et du contenu du sac herniaire. À grandes tailles défaut, prolapsus d'une quantité importante de tissu cérébral, ainsi qu'en présence de microcéphalie et d'hydrocéphalie, le pronostic pour la vie et la santé est extrêmement défavorable.
Livraison par opération césarienne pas montré dans ces observations. Il est possible de recommander une décompression du sac herniaire pour créer les conditions d'un accouchement par le canal génital naturel. Une césarienne peut être recommandée s'il y a un petit défaut et si le sac herniaire est petit.
Microcéphalie (microencéphalie) est un syndrome clinique caractérisé par une diminution du périmètre crânien et un retard mental. Elle survient avec une fréquence de 1 nouveau-né sur 1360, avec des anomalies combinées de 1,6 pour 1000 naissances vivantes. La microcéphalie est une maladie polyétiologique, dans le développement de laquelle des facteurs génétiques (aberrations chromosomiques, défauts monogéniques) et environnementaux jouent un rôle important. Le pronostic dépend de la présence d'anomalies associées. La trisomie sur les chromosomes 13, 18, le syndrome de Meckel sont des lésions fatales. L'examen prénatal doit comprendre la détermination du caryotype fœtal et une échographie approfondie. En l'absence d'anomalies concomitantes, le pronostic dépend de la taille de la tête : plus elle est petite, plus l'indice de développement intellectuel est faible. La microcéphalie est une maladie incurable. Tactiques obstétriques - interruption de grossesse avant que le fœtus n'atteigne la viabilité.
ANOMALIES DES STRUCTURES FACIALES ET DU COU
Visage fendu(fente labiale et palatine) est un défaut linéaire s'étendant du bord de la lèvre à l'ouverture nasale.
La fente palatine, associée à la fente labiale, à travers les processus alvéolaires et le palais dur peut se propager à la cavité nasale ou même au bas de l'orbite. Une fente labiale bilatérale est observée chez 20%, une fente labio-palatine - 25%. Avec une lésion unilatérale, la fente est plus souvent située à gauche. La fente faciale représente environ 13% de toutes les malformations et est enregistrée avec une fréquence de 1:800 naissances vivantes. Les garçons ont plus souvent des fentes que les filles. Les anomalies combinées sont retrouvées dans 50 % des cas avec une fente palatine isolée et seulement dans 13 % avec une fente labio-palatine. Les structures faciales se forment entre la 4e et la 10e semaine de grossesse. Les structures frontonasales non appariées fusionnent avec les structures appariées maxillaire et mandibulaire.
mes tubercules. Dans ces observations, lorsque le processus de fusion n'est pas terminé, des fentes se forment. En règle générale, il est possible de diagnostiquer une fente faciale uniquement au deuxième trimestre de la grossesse avec une échographie de dépistage. La détection prénatale d'un défaut par échographie est difficile, cependant, grâce à l'échographie et à la cartographie Doppler couleur, les possibilités de son diagnostic s'élargissent. L'échographie Doppler peut visualiser le mouvement du liquide à travers le nez, la bouche et le pharynx. En présence d'une fente, la nature du mouvement du fluide change. L'échographie tridimensionnelle peut clarifier le diagnostic dans ces observations lorsqu'une fente a été suspectée dans une étude bidimensionnelle, mais sa visualisation claire n'a pas été obtenue. Il est possible de diagnostiquer une anomalie à l'aide de la fœtoscopie, y compris l'embryoscopie. En l'absence d'anomalies associées, des tactiques obstétriques généralement acceptées sont utilisées, quel que soit le moment du diagnostic. Prendre de l'acide folique avant et pendant la prochaine grossesse peut réduire le risque de fentes.
Le dédoublement de la lèvre supérieure (fente labiale) n'interfère pas avec l'acte de succion et n'est qu'un défaut esthétique. Avec une combinaison de fractionnement de la lèvre supérieure, de la mâchoire et du palais dur (fente palatine), des troubles fonctionnels sont notés: lors de la succion, le lait s'écoule par le nez en raison de sa communication avec la cavité buccale; le lait peut être inhalé. Le pronostic est favorable : les méthodes chirurgicales modernes permettent de réaliser la correction des défauts esthétiques et fonctionnels.
hygroma kystique(lymphangiome ou conséquences d'une obstruction du tronc lymphatique jugulaire) est une accumulation de liquide enkysté (Fig. 30). Elle se caractérise par la présence de kystes uniques ou multiples des tissus mous dans le cou, résultant de troubles du système lymphatique. Les hygromes kystiques surviennent avec une fréquence de 1:200 fausses couches spontanées (taille coccyx-pariétale du fœtus supérieure à 30 mm). L'hygroma kystique est souvent associé à des aberrations chromosomiques (syndrome de Turner, trisomies de 13, 18, 21 paires de chromosomes, mosaïcisme). En tant qu'anomalie isolée, elle est héritée de manière autosomique récessive. Pronostic : dans la plupart des cas, le fœtus meurt au cours des deux premiers trimestres de la grossesse. Environ 90% nécessitent un traitement chirurgical, 31% développent des problèmes de déglutition et une obstruction des voies respiratoires.
 Riz. trente. Image échographique d'hygroma kystique du cou fœtal au cours d'une grossesse de 16 semaines (une grande formation de liquide est visualisée dans le cou du fœtus - indiquée par une flèche)
Riz. trente. Image échographique d'hygroma kystique du cou fœtal au cours d'une grossesse de 16 semaines (une grande formation de liquide est visualisée dans le cou du fœtus - indiquée par une flèche)
façons. Une parésie du nerf facial due à un traitement chirurgical survient chez 24 % des patients.
La tactique obstétricale consiste à mettre fin à la grossesse avec un diagnostic précoce de l'hygroma kystique du cou du fœtus, avec une grossesse à terme, l'accouchement est effectué par le canal de naissance naturel.
MALADIES CARDIAQUES CONGÉNITALES
La fréquence des malformations cardiaques congénitales (CHD) varie de 1-2 à 8-9 pour 1000 naissances vivantes. Les coronaropathies les plus fréquentes sont les communications interauriculaires et ventriculaires, la persistance du canal artériel, la sténose de l'artère pulmonaire, l'hypoplasie du cœur gauche, le ventricule unique, etc. Dans 90 % des cas, les coronaropathies résultent d'une atteinte multifactorielle (prédisposition génétique et facteurs environnementaux). Le risque de récidive du défaut est de 2 à 5 % après la naissance d'un enfant et de 10 à 15 % après la naissance de deux enfants malades. Hérédité monogénique
le vieillissement est observé chez 1 à 2 % des enfants atteints de cardiopathie congénitale. Des anomalies chromosomiques sont retrouvées chez 5% des enfants, dont les trisomies sont les principales. Chez 1 à 2% des nouveau-nés, il existe un effet combiné de divers tératogènes. L'échocardiographie fœtale est la méthode la plus informative pour le diagnostic prénatal des cardiopathies congénitales. Les indications du diagnostic prénatal sont déterminées par l'état de la mère et du fœtus.
1. Indications dues à l'état de la mère :
La présence de coronaropathies chez les membres de la famille ;
Diabète;
Prendre des médicaments enceintes pendant l'organogenèse;
Alcoolisme;
Le lupus érythémateux disséminé;
Phénylcétonurie.
2. Indications dues à l'état du fœtus :
polyhydramnios;
hydropisie non immunitaire ;
Troubles du rythme cardiaque ;
Défauts extracardiaques ;
Troubles chromosomiques ;
Forme symétrique du retard de croissance intra-utérin du fœtus. Le pronostic dépend du type de défaut, de la présence d'anomalies concomitantes et d'anomalies chromosomiques.
La tactique obstétricale est qu'après une étude échocardiographique approfondie, une cordo ou une amniocentèse est effectuée afin d'obtenir du matériel pour l'analyse chromosomique. Si une maladie coronarienne est détectée chez un fœtus non viable, l'interruption de grossesse est indiquée. Avec une grossesse à terme, il est préférable d'effectuer l'accouchement dans des centres périnataux spécialisés. Avec des défauts combinés et des anomalies génétiques, l'interruption de grossesse est nécessaire à tout moment.
seul ventricule du cœur. Il s'agit d'une malformation congénitale sévère dans laquelle les ventricules du cœur sont représentés par une chambre unique ou un grand ventricule dominant en combinaison avec une jonction auriculo-ventriculaire commune contenant deux valves auriculo-ventriculaires. La fréquence d'apparition du défaut n'a pas été déterminée avec précision. Le ventricule unique est facilement diagnostiqué à l'aide d'une section standard à quatre chambres du cœur fœtal. Le seul
le ventricule morphologiquement peut être à la fois droit et gauche. Le taux de survie global pour tous les types de ventricule unique chez les patients sans traitement chirurgical est de 30 %. Le ventricule unique est souvent associé à des anomalies chromosomiques, des troubles génétiques (syndrome de Holt-Oram), un syndrome d'asplénie/polysplénie, souvent formé dans certaines maladies maternelles, et également dans le contexte des effets tératogènes de l'acide rétinoïque. L'examen prénatal lorsqu'un seul ventricule est trouvé doit inclure un caryotypage et un examen détaillé de l'anatomie échographique du fœtus. L'évolution clinique de la maladie et les tactiques de prise en charge en période néonatale sont déterminées par l'état du flux sanguin pulmonaire et systémique.
Communication interauriculaire(AMPP) (fig. 31). Représente une déficience du septum séparant les oreillettes. On l'observe dans 17 % de toutes les malformations cardiaques congénitales et c'est son anomalie structurelle la plus courante. Souvent associé à d'autres anomalies intracardiaques, ainsi qu'à une hydropisie fœtale non immunitaire. Peut-être une combinaison avec des anomalies chromosomiques. La plupart des petits TSA ne sont pas détectés lors de l'échographie fœtale prénatale. Le diagnostic ne peut être fait qu'à l'aide de plusieurs coupes et d'une imagerie Doppler couleur. L'examen prénatal lors de la détection d'un TSA devrait inclure
 Riz. 31. Image échographique d'une communication interauriculaire étendue (indiquée par une flèche)
Riz. 31. Image échographique d'une communication interauriculaire étendue (indiquée par une flèche)
pour commencer la détermination du caryotype et une étude détaillée de l'anatomie échographique du fœtus. L'identification d'un TSA isolé dans la période prénatale ne nécessite pas de changement de tactique de grossesse et d'accouchement. DANS dates tardives grossesse, une évaluation dynamique de l'état du fœtus doit être effectuée.
Communication interventriculaire(VMZHP). Représente une déficience du septum séparant les ventricules. Selon la localisation, on distingue les défauts du septum supérieur (au niveau des valves mitrale et tricuspide), de la partie musculaire et de la section de sortie du septum (sous-aortique, sous-pulmonaire). Par taille, les VSD sont divisés en petits (jusqu'à 4 mm) et grands. Le VSD peut être isolé ou associé à d'autres anomalies, anomalies chromosomiques et syndromes héréditaires. Dans la structure générale des malformations cardiaques congénitales, environ 20 % sont des VSD isolées, qui sont les malformations les plus fréquemment diagnostiquées. La fréquence des petits défauts musculaires hémodynamiquement insignifiants atteint 53:1000 naissances vivantes. Environ 90% de ces défauts se ferment spontanément à l'âge de 10 mois et n'affectent pas le pronostic pour la vie et la santé.
La plupart des petits VSD ne sont pas détectés lors de l'échographie fœtale prénatale. Le diagnostic ne peut être fait qu'à l'aide de plusieurs coupes et d'une imagerie Doppler couleur. Le plus souvent, la VSD est isolée, mais peut être associée à des anomalies chromosomiques, des troubles géniques, des syndromes de malformations multiples. L'examen prénatal pour un VSD doit inclure un caryotypage et un examen détaillé de l'anatomie fœtale par ultrasons. L'identification d'un VSD isolé dans la période prénatale ne nécessite pas de changement dans la prise en charge de la grossesse et de l'accouchement. En fin de grossesse, une évaluation dynamique du fœtus doit être réalisée. En cas de suspicion de VSD, les parents doivent recevoir des informations complètes sur le pronostic pour la vie et la santé de l'enfant à naître et en informer le pédiatre pour assurer une surveillance adéquate du nouveau-né. Même avec de gros VSD, la maladie peut parfois être asymptomatique pendant 2 à 8 semaines. Dans 50% des cas, les petits défauts se referment spontanément avant l'âge de 5 ans, et les 80% restants disparaissent en adolescence. La plupart des patients atteints de VSD non compliqué ont un bon pronostic pour la vie et la santé. Avec un débit favorable
maladie des restrictions importantes sur l'activité physique n'est pas nécessaire.
Anomalie d'Ebstein- cardiopathie congénitale, caractérisée par un développement et une localisation anormaux des feuillets de la valve tricuspide. Avec l'anomalie d'Ebstein, les voiles septales et postérieures de la valve tricuspide se développent directement à partir de l'endocarde du ventricule droit du cœur, ce qui entraîne un déplacement de la valve anormale profondément dans le ventricule droit et une division du ventricule en deux sections : distale (sous-valvulaire) - actif et proximal (supravalvulaire ou auriculaire) - passif. Le service supravalvulaire, relié à l'oreillette droite, forme une formation fonctionnelle unique. L'anomalie d'Ebstein représente 0,5 % de toutes les malformations cardiaques congénitales. L'anomalie d'Ebstein peut être facilement diagnostiquée en examinant un cœur fœtal standard à quatre cavités, car elle est presque toujours accompagnée d'une cardiomégalie. Le diagnostic prénatal de l'anomalie est basé sur la détection d'un cœur droit considérablement élargi en raison de l'oreillette droite. Le point clé dans le diagnostic de l'anomalie d'Ebstein est la visualisation d'une valve tricuspide déplacée sur fond d'oreillette droite dilatée et de myocarde ventriculaire droit normal. Une valeur pronostique importante dans l'anomalie d'Ebstein est la détection d'une régurgitation tricuspide lors de l'échocardiographie Doppler du fœtus. La première prénatale diagnostic par ultrasons L'anomalie d'Ebstein a été réalisée à 18-19 semaines de grossesse. Le pronostic de vie avec l'anomalie d'Ebstein est généralement favorable dans les cas où les enfants survivent au cours de la première année de vie sans traitement chirurgical. L'anomalie d'Ebstein n'est pas souvent associée à des aberrations chromosomiques et à des syndromes de malformations congénitales multiples. Des anomalies extracardiaques sont observées dans 25 %. Le résultat dans la période néonatale dépend de la gravité de la modification de la valve tricuspide. Les enfants atteints d'insuffisance valvulaire tricuspide sévère ont un pourcentage élevé de décès. Cliniquement, l'insuffisance de la valve tricuspide se manifeste par une augmentation de la cyanose, de l'acidose et des signes d'insuffisance cardiaque. Le traitement chirurgical est indiqué chez les patients présentant des symptômes graves de la maladie qui interfèrent avec la vie normale de l'enfant. L'opération consiste à fermer le septum
défaut, plasticité de la valve tricuspide et son mouvement vers un endroit typique. La mortalité hospitalière est de 6,3 %.
Tétralogie de Fallot- une malformation complexe, comprenant plusieurs anomalies de la structure du cœur : communication interventriculaire, dextroposition aortique, obstruction de l'artère pulmonaire de sortie et hypertrophie ventriculaire droite. Dans la structure générale des malformations cardiaques congénitales chez les naissances vivantes, la tétralogie de Fallot est de 4 à 11 %. Il est très difficile de diagnostiquer la tétrade de Fallot lors de l'étude d'un cœur fœtal à quatre chambres. Lorsqu'il est coupé à travers les sorties des artères principales, un VSD sous-aortique typique et une dextraposition aortique peuvent être observés. Un critère supplémentaire important est l'expansion et le déplacement de la racine aortique. La tétralogie de Fallot est un défaut de type bleu, c'est-à-dire chez les nouveau-nés, la cyanose prononcée est déterminée à l'âge de 6 semaines à 6 mois. La tétralogie de Fallot fait référence à des malformations cardiaques difficiles à diagnostiquer qui restent souvent non détectées par échographie de dépistage jusqu'à 22 semaines de gestation. Le plus souvent, ce défaut est diagnostiqué au troisième trimestre de la grossesse ou après la naissance. La tétralogie de Fallot ne nécessite pas de tactique de gestion spécifique. Si cette pathologie est détectée, un examen approfondi et une consultation prénatale sont nécessaires. Près de 30% des naissances vivantes avec tétrade de Fallot ont des anomalies extracardiaques combinées. Actuellement, plus de 30 syndromes de malformations multiples ont été décrits, dont la structure comprend la tétralogie de Fallot. L'examen prénatal pour la détection de la tétrade de Fallot doit inclure la détermination du caryotype et une étude détaillée de l'anatomie échographique du fœtus. Le pronostic vital dans la tétralogie de Fallot dépend en grande partie du degré d'obstruction des voies d'éjection du ventricule droit. Plus de 90% des patients ayant subi une correction complète de la tétrade de Fallot survivent jusqu'à l'âge adulte. A long terme, 80% des patients se sentent satisfaits et ont des paramètres fonctionnels normaux.
Transposition des grandes artères- une maladie cardiaque dans laquelle l'aorte, ou la majeure partie, sort du ventricule droit et l'artère pulmonaire du ventricule gauche. Il représente 5 à 7 % de toutes les malformations cardiaques congénitales. Habituellement non diagnostiqué dans la période prénatale lors du dépistage car l'étude du cœur fœtal est limitée à l'étude
seulement une coupe à quatre chambres. Pour identifier le défaut, la visualisation des vaisseaux principaux est nécessaire avec l'étude de leur emplacement les uns par rapport aux autres. Normalement, les artères principales se croisent et lors de la transposition, elles quittent les ventricules en parallèle: l'aorte - du ventricule droit, l'artère pulmonaire - de la gauche. La transposition des artères principales avec des cloisons interventriculaires et interauriculaires intactes n'est pas compatible avec la vie. Environ 8 % des naissances vivantes avec transposition des artères principales ont des anomalies extracardiaques associées. L'examen prénatal doit comprendre la détermination du caryotype et une étude détaillée de l'anatomie échographique du fœtus. La plupart des nouveau-nés présentant une transposition des artères principales et un septum interventriculaire intact présentent une cyanose prononcée dès les premiers jours de vie. Une correction chirurgicale doit être effectuée dès qu'un mélange inadéquat des flux sanguins est détecté. Le taux de mortalité des nouveau-nés avec ce type de traitement chirurgical est inférieur à 5-10%.
MALADIES DE LA POITRINE
hernie diaphragmatique congénitale- un défaut résultant d'un ralentissement du processus de fermeture du canal pleuropéritonéal. Avec ce défaut, il y a généralement un développement insuffisant de la partie postéro-latérale de la moitié gauche du diaphragme. Le manque de séparation entre la cavité abdominale et la poitrine entraîne le mouvement de l'estomac, de la rate, des intestins et même du foie dans la cavité thoracique, qui peut s'accompagner d'un déplacement médiastinal et provoquer une compression des poumons. En conséquence, une hypoplasie pulmonaire bilatérale de gravité variable se développe souvent. Le sous-développement des poumons entraîne une formation anormale de leur système vasculaire et une hypertension pulmonaire secondaire. La hernie diaphragmatique congénitale survient chez environ 1 nouveau-né sur 2400.
Il existe quatre principaux types de défauts : postérolatéral (hernie de Bochdalek), antérolatéral, sternal et hernie de Morgagni. Les hernies diaphragmatiques bilatérales représentent 1 % de tous les types de défauts. Mouvement du coeur vers la droite poitrine en combinaison avec une structure écho-négative (estomac) dans sa moitié gauche, il est le plus souvent diagnostiqué avec une hernie diaphragmatique du côté gauche.
Avec les hernies du côté droit, le cœur est généralement déplacé vers la gauche. Dans la poitrine, les intestins et le foie peuvent également être visualisés. Avec ce défaut, on note souvent un polyhydramnios. Des anomalies combinées sont observées chez 23 % des fœtus. Parmi eux, les malformations cardiaques congénitales prédominent, qui représentent 16 %. Le diagnostic du défaut peut être effectué dès 14 semaines de grossesse. La mortalité dans la hernie diaphragmatique congénitale est corrélée au moment de la détection de l'anomalie : seuls 33 % des nouveau-nés porteurs d'une anomalie survivent dans les cas où le diagnostic a été posé avant 25 semaines, et 67 % si la hernie a été détectée à une date ultérieure. Les anomalies diaphragmatiques ont généralement une origine multifactorielle, cependant, 12 % des cas sont associés à d'autres malformations ou font partie de syndromes chromosomiques et non chromosomiques. L'examen prénatal doit nécessairement inclure la détermination du caryotype fœtal et une échographie détaillée. Si des anomalies combinées sont détectées, le diagnostic différentiel ne peut être réalisé qu'au cours d'une consultation impliquant des généticiens, des syndromologues et des pédiatres. Il convient de conseiller aux parents de consulter un chirurgien pédiatrique pour discuter des caractéristiques des tactiques de traitement pendant la période néonatale, du pronostic vital et de la santé. L'évolution de la période néonatale dépend de la sévérité de l'hypoplasie pulmonaire et de la sévérité de l'hypertension. La taille de la hernie et le volume de tissu pulmonaire fonctionnel ont également un impact significatif sur l'issue de la période néonatale. Un développement anormal des poumons peut être prédit en présence de polyhydramnios, de dilatation de l'estomac, ainsi que du mouvement du foie fœtal dans la cavité thoracique. Selon la littérature, seulement 22 % des enfants diagnostiqués avant la naissance ont survécu. Même avec une hernie diaphragmatique congénitale isolée, seuls 40% survivent. La mort néonatale résulte généralement d'une hypertension pulmonaire et/ou d'une insuffisance respiratoire.
ANOMALIES DE FORMATION DES PAROIS DE LA CAVITÉ ABDOMINALE ET DE DÉVELOPPEMENT DU TRACTUS GASTRO-INTESTINAL
Omphalocèle (hernie ombilicale)(Fig. 32). Se produit à la suite d'un non-retour d'organes cavité abdominale de la cavité amniotique à travers l'anneau ombilical. L'omphalocèle peut inclure n'importe quel
 Riz. 32. Image échographique d'un omphalocèle (un sac herniaire est visualisé contenant des anses intestinales et un foie)
Riz. 32. Image échographique d'un omphalocèle (un sac herniaire est visualisé contenant des anses intestinales et un foie)
organes viscéraux. La taille de la formation herniaire est déterminée par son contenu.
Il est recouvert d'une membrane amniopéritonéale, le long de la surface latérale de laquelle passent les vaisseaux du cordon ombilical. La fréquence de l'omphalocèle est de 1 sur 3000 à 6000 nouveau-nés. Il existe des formes isolées et combinées d'omphalocèle. Cette pathologie dans 35 à 58% s'accompagne de trisomie, 47% - malformations cardiaques congénitales, 40% - malformations du système génito-urinaire, 39% - malformations du tube neural. Un retard de croissance intra-utérin est détecté dans 20% des cas.
Le diagnostic échographique prénatal repose sur la détection d'une formation ronde ou ovale remplie d'organes abdominaux et adjacente directement à la paroi abdominale antérieure. Le plus souvent, la composition du contenu herniaire comprend les anses intestinales et le foie. Le cordon ombilical est attaché directement au sac herniaire. Dans certains cas, un diagnostic prénatal peut être établi à la fin du premier trimestre de la grossesse, bien que dans la plupart des cas, un omphalocèle soit détecté au deuxième trimestre. Le pronostic dépend des anomalies qui l'accompagnent. Les pertes périnatales sont plus souvent associées à une maladie coronarienne, chromosomique
aberrations et prématurité. Le plus gros défaut est éliminé par une opération en une seule étape, avec une grande, des opérations en plusieurs étapes sont effectuées pour fermer le trou dans la paroi abdominale antérieure avec une membrane en silicone ou en téflon. La tactique obstétricale est déterminée par la période de détection du défaut, la présence d'anomalies combinées et de troubles chromosomiques. Si un défaut est détecté au début de la grossesse, il doit être interrompu. En cas de détection d'anomalies concomitantes incompatibles avec la vie, il est nécessaire d'interrompre la grossesse à tout moment. La méthode d'accouchement dépend de la viabilité du fœtus, car lors de l'accouchement avec un gros omphalocèle, le sac herniaire peut se rompre et une infection des organes internes du fœtus peut survenir.
Gastroschisis- défect de la paroi abdominale antérieure dans la région ombilicale avec éventération des anses intestinales couvertes d'exsudat inflammatoire. Le défaut est généralement situé à droite du nombril, les organes herniaires n'ont pas de membrane. La fréquence du gastroschisis est de 0,94 pour 10 000 nouveau-nés. La fréquence du défaut chez les femmes enceintes de moins de 20 ans est plus élevée et est de 7 pour 10 000 nouveau-nés.
Depuis la fin des années 70. 20ième siècle en Europe et aux États-Unis, la tendance à l'augmentation de la fréquence des naissances d'enfants atteints de gastroschisis se poursuit. Attribuez des formes isolées et combinées. Le gastroschisis isolé est plus fréquent et représente en moyenne 79 %. La forme combinée est détectée dans 10 à 30 % des cas et est le plus souvent une association de gastroschisis avec atrésie ou sténose intestinale. Entre autres anomalies, malformations congénitales du cœur et du système urinaire, syndrome ventre de pruneau, hydrocéphalie, bas et polyhydramnios.
L'anomalie survient sporadiquement, mais il existe des observations d'une maladie familiale avec un type de transmission autosomique dominant.
Le premier diagnostic échographique prénatal utilisant l'échographie transvaginale a été réalisé à 12 semaines de gestation. Dans la plupart des cas, le diagnostic est établi au deuxième trimestre de la grossesse, car dans les premiers stades (10-13 semaines), un diagnostic faussement positif est possible en raison de la présence d'une hernie intestinale physiologique chez le fœtus. Le diagnostic échographique prénatal du gastroschisis est généralement basé sur la visualisation des anses intestinales liquide amniotique près de la paroi abdominale antérieure du fœtus. Parfois, en plus des anses intestinales, au-delà
d'autres organes peuvent être situés dans la cavité abdominale. La précision du diagnostic échographique du gastroschisis au cours des trimestres II et III de la grossesse varie de 70 à 95% et dépend de l'âge gestationnel, de la position du fœtus, de la taille du défaut et du nombre d'organes situés à l'extérieur de la paroi abdominale antérieure. .
Le pronostic global des nouveau-nés atteints de gastroschisis isolé est bon, plus de 90 % des nourrissons survivant. Lors de la prolongation de la grossesse, les tactiques de gestion au deuxième trimestre n'ont pas de particularités. En raison de la faible fréquence de l'association d'un gastroschisis isolé avec des anomalies chromosomiques, le caryotypage prénatal peut être évité. Au troisième trimestre de la grossesse, il est nécessaire de procéder à une évaluation dynamique de l'état fonctionnel du fœtus, car la fréquence de détresse dans le gastroschisis est assez élevée et un retard de croissance intra-utérin se forme dans 23 à 50% des cas.
Si un gastroschisis est détecté avant la viabilité du fœtus, un avortement doit être pratiqué. En cas de grossesse à terme, l'accouchement a lieu dans un établissement où des soins chirurgicaux peuvent être prodigués.
atrésie duodénale est la cause la plus fréquente d'occlusion de l'intestin grêle. La fréquence de l'anomalie est de 1 pour 10 000 naissances vivantes. L'étiologie est inconnue. La survenue d'un défaut sous l'influence de facteurs tératogènes est possible. Les observations familiales de l'atrésie pylo-duodénale à transmission autosomique récessive sont décrites. Chez 30 à 52 % des patients, l'anomalie est isolée, et chez 37 %, on retrouve des malformations du système squelettique : nombre anormal de côtes, agénésie du sacrum, pied de cheval, côtes cervicales bilatérales, absence bilatérale des premiers doigts , etc. Dans 2%, des anomalies combinées du tractus gastro-intestinal sont diagnostiquées: rotation incomplète de l'estomac, atrésie de l'œsophage, de l'iléon et de l'anus, transposition du foie. Chez 8 à 20% des patients, des malformations cardiaques congénitales sont détectées, dans environ 1/3 des cas, une atrésie duodénale est associée à une trisomie pour 21 paires de chromosomes. Les principales constatations échographiques prénatales dans l'atrésie duodénale sont l'hydramnios et le signe classique "double bulle" dans l'abdomen du fœtus. L'image de la "double bulle" apparaît à la suite de l'expansion d'une partie du duodénum et de l'estomac. La constriction entre ces formations est formée par la partie pylorique de l'estomac
ka et est d'une grande importance pour un diagnostic prénatal précis de ce défaut. Dans la grande majorité des cas, l'atrésie duodénale est diagnostiquée aux IIe et IIIe trimestres de la grossesse. En termes antérieurs, le diagnostic de ce défaut présente des difficultés importantes. Le premier diagnostic d'atrésie duodénale a été posé à 14 semaines.
Pour déterminer les tactiques obstétriques, une évaluation échographique détaillée de l'anatomie des organes internes du fœtus et de son caryotype est effectuée. Avant le début de la période de viabilité fœtale, une interruption de grossesse est indiquée. Si une anomalie isolée est détectée au troisième trimestre, une prolongation de grossesse est possible, suivie d'un accouchement au centre régional de périnatalité et d'une correction chirurgicale de la malformation.
Ascite isolée. L'ascite est l'accumulation de liquide dans la cavité péritonéale. La fréquence n'a pas été déterminée avec précision. À l'examen échographique du fœtus, l'ascite se manifeste par la présence d'un espace écho-négatif d'une épaisseur de 5 mm ou plus dans la cavité abdominale. En période prénatale, l'ascite peut être isolée ou être l'un des signes d'une hydropisie d'origine non immunitaire. Outre l'ascite, l'hydropisie du fœtus se caractérise par la présence d'œdème sous-cutané, d'épanchements pleuraux et péricardiques, ainsi que par une augmentation de l'épaisseur du placenta de plus de 6 cm, un polyhydramnios et une hydrocèle.
L'ascite peut être associée à diverses anomalies structurelles. Un examen approfondi de tous les organes internes du fœtus est donc indiqué. Parmi les causes d'ascite isolée, il faut distinguer la péritonite méconiale et l'hépatite congénitale.
Jusqu'à présent, il n'y a pas eu de publications dans la littérature sur la détection de l'ascite isolée au premier trimestre de la grossesse. La plupart des observations de diagnostic précoce d'ascite surviennent au début du deuxième trimestre de la grossesse. Les anomalies chromosomiques sont l'une des causes les plus fréquentes d'hydropisie non immunitaire. Avec l'ascite isolée, les défauts chromosomiques sont moins fréquents, mais ils doivent être pris en compte comme arrière-plan possible pour le développement de cette pathologie. Lorsque l'ascite est détectée chez le fœtus, il faut d'abord exclure les anomalies combinées et les infections intra-utérines. L'évolution de l'ascite fœtale dépend de son étiologie. L'ascite isolée idiopathique a un pronostic favorable. Dans plus de 50% des observations, sa disparition spontanée est notée. La cause la plus fréquente d'ascite isolée est l'infection intra-utérine.
parvovirus B19. Lors de la prolongation de la grossesse, il est nécessaire d'effectuer une observation échographique dynamique, y compris une évaluation Doppler du flux sanguin dans le canal veineux. Avec des valeurs normales de débit sanguin dans le canal veineux chez les fœtus présentant une ascite, dans la plupart des cas, une issue périnatale favorable est notée. Avec une augmentation de l'ascite, certains auteurs recommandent une ponction thérapeutique, en particulier dans les cas où le processus progresse en fin de grossesse. Le but principal de la ponction est d'éviter les désagréments activité de travail et détresse respiratoire en période néonatale. Si une ascite isolée est détectée pendant la période prénatale et qu'une comorbidité incompatible avec la vie est exclue, l'enfant a besoin d'une surveillance dynamique attentive et d'un traitement symptomatique après l'accouchement.
Malformations des REINS ET DES VOIES URINAIRES
Agénésie rénale- absence complète des deux reins. L'apparition d'un défaut est due à une violation de la chaîne séquentielle des processus d'embryogenèse normale du pronéphros au métanéphros. La fréquence est en moyenne de 1:4500 nouveau-nés. On note qu'on le retrouve deux fois plus souvent chez les garçons. La triade pathognomonique des signes échographiques d'agénésie rénale chez le fœtus est représentée par l'absence de leur écho et de leur vessie, ainsi que par un oligohydramnios sévère. L'oligoamnios fait référence à des manifestations tardives et peut être détecté après la 16e à la 18e semaine de grossesse. Habituellement, l'agénésie rénale bilatérale s'accompagne d'une forme symétrique de syndrome de retard de croissance fœtale. L'agénésie rénale est le plus souvent sporadique, mais peut être associée à diverses anomalies des organes internes. Les conséquences directes de l'oligohydramnios sont l'hypoplasie pulmonaire, les malformations squelettiques et faciales, le syndrome de retard de croissance fœtale. L'agénésie rénale a été décrite dans plus de 140 syndromes de malformations congénitales multiples, d'anomalies chromosomiques et d'effets tératogènes. Une fois diagnostiqué, le caryotypage doit être effectué avant la naissance ou après la naissance pour exclure les anomalies chromosomiques. Dans toutes les observations d'agénésie rénale, un examen anatomopathologique complet est nécessaire. L'échographie est montrée
examens rénaux chez le plus proche parent. Avec la détection prénatale d'un défaut, l'interruption de grossesse à tout moment doit être recommandée. Si la famille décide de prolonger la grossesse, des tactiques obstétriques conservatrices sont indiquées.
Maladie polykystique des reins autosomique récessive (forme infantile). Elle se manifeste par une augmentation symétrique bilatérale des reins à la suite du remplacement du parenchyme par un canal collecteur secondairement élargi sans prolifération de tissu conjonctif. Elle va de la variante létale classique aux formes infantiles, juvéniles et même adultes. Dans la forme infantile, il existe une dilatation secondaire et une hyperplasie des canaux collecteurs normalement formés des reins. Les reins sont affectés de manière symétrique, tandis que les formations kystiques ont une taille de 1 à 2 mm. La fréquence est de 1,3-5,9:1000 nouveau-nés. Les principaux critères échographiques de malformation sont les reins hyperéchogènes hypertrophiés, l'absence d'écho vésical et l'oligohydramnios. L'augmentation de la taille des reins est parfois si importante qu'ils occupent une grande partie de la section transversale de l'abdomen fœtal. Une image échographique typique peut n'apparaître qu'au troisième trimestre de la grossesse. Le pronostic est défavorable. La mort vient d'une insuffisance rénale. La tactique obstétricale consiste à interrompre la grossesse à tout moment.
Maladie polykystique des reins de l'adulte(maladie autosomique dominante, polykystose hépatorénale de type adulte, syndrome de Potter de type III) se caractérise par le remplacement du parenchyme rénal par de nombreux kystes de différentes tailles, qui se forment en raison de l'expansion des canaux collecteurs et d'autres segments tubulaires du néphron. Les reins sont touchés des deux côtés et hypertrophiés, mais un processus unilatéral peut être la première manifestation de la maladie. Le foie est également impliqué dans le processus pathologique - une fibrose périportale se développe, qui a un caractère focal. L'étiologie de la maladie est inconnue, mais le type d'hérédité entraîne un risque de 50% de développer la maladie et son foyer génétique est situé sur la 16e paire de chromosomes. Le gène mutant est porté par une personne sur 1 000. La pénétration des gènes survient dans 100% des cas, cependant, l'évolution de la maladie peut varier de formes graves avec une issue fatale en période néonatale à des formes asymptomatiques détectées uniquement à l'autopsie.
Polykystose rénale(maladie polykystique, maladie rénale kystique, syndrome de Potter de type II, maladie rénale dysplasique) se caractérise par une dégénérescence kystique du parenchyme rénal due à l'expansion primaire des tubules rénaux. Dans la dysplasie rénale multikystique, l'uretère et le bassin sont le plus souvent atrésés ou absents. Le processus peut être bilatéral, unilatéral et segmentaire. Dans la dysplasie multikystique, le rein est généralement considérablement agrandi; la forme habituelle et le tissu normal sont absents. Le rein est représenté par de multiples kystes au contenu anéchoïque (Fig. 33).
 Riz. 33.Échogramme de reins fœtaux polykystiques bilatéraux (reins fortement hypertrophiés contenant plusieurs kystes de différents diamètres - indiqués par une flèche)
Riz. 33.Échogramme de reins fœtaux polykystiques bilatéraux (reins fortement hypertrophiés contenant plusieurs kystes de différents diamètres - indiqués par une flèche)
La taille des kystes varie dans une gamme assez large et dépend de la durée de la grossesse. Plus près du terme, le diamètre des kystes peut atteindre 3,5 à 4 cm.La vessie est généralement visualisée avec un processus unilatéral et n'est pas visualisée avec un processus bilatéral. Avec un processus bilatéral, un oligohydramnios est généralement noté. La maladie survient principalement de façon sporadique et peut être secondaire en association avec d'autres syndromes. obstétrique
tactique dans un processus bilatéral diagnostiqué dans les premiers stades, en raison d'un pronostic défavorable, consiste à interrompre la grossesse. Avec un processus unilatéral et un caryotype normal sans anomalies associées, un accouchement conventionnel est indiqué, suivi d'une consultation de l'enfant avec un spécialiste.
Dilatation des voies urinaires. Des anomalies du système génito-urinaire chez le fœtus, accompagnées de l'expansion des voies urinaires, peuvent être causées raisons diverses, dont le reflux vésico-urétéral, la pyélectasie idiopathique, les troubles obstructifs, etc. D'un point de vue clinique, il convient de distinguer la pyélectasie et l'uropathie obstructive en période prénatale.
Pyélectasie. La pyélectasie est caractérisée par une accumulation excessive de liquide et une expansion du bassinet du rein fœtal.
La pyélectasie est la découverte la plus fréquente à l'échographie fœtale. La fréquence de son développement n'a pas été établie, car cette pathologie est un phénomène sporadique. Après la naissance, les garçons en sont diagnostiqués 5 fois plus souvent. Chez 27% des enfants atteints d'hydronéphrose, un reflux vésico-urétéral, un doublement bilatéral des uretères, un mégauretère obstructif bilatéral, un rein controlatéral non fonctionnel et son agénésie sont détectés, chez 19% - des anomalies du développement de divers organes. Pour le diagnostic échographique prénatal de la pyélectasie, les reins fœtaux doivent être examinés à la fois en balayage transversal et longitudinal. La dilatation du pelvis rénal est jugée sur la base de sa taille antéro-postérieure lors d'un balayage transversal du rein. La plupart des chercheurs considèrent l'expansion pyélectasique du bassin rénal au cours du IIe trimestre de la grossesse de plus de 5 mm et au cours du IIIe trimestre - de plus de 8 mm. Avec l'expansion du bassin rénal du fœtus de plus de 10 mm, il est d'usage de parler d'hydronéphrose. La classification la plus courante de l'hydronéphrose chez le fœtus est la suivante :
Grade I (dilatation physiologique):
Bassin rénal : dimension antéro-postérieure<1 см;
Couche corticale : non modifiée.
Classe II :
Bassin rénal : 1,0-1,5 cm ;
Tasses : non visualisées ;
Couche corticale : non modifiée.
Degré III :
Bassin rénal : dimension antéropostérieure > 1,5 cm ;
Calices : légèrement dilatés ;
Couche corticale : non modifiée.
Classe IV :
Bassin rénal : dimension antéropostérieure > 1,5 cm ;
Calice : Modérément dilaté ;
Couche corticale : légèrement modifiée.
Degré V :
Bassin rénal : dimension antéropostérieure > 1,5 cm ;
Calices : fortement élargis ;
Couche corticale : atrophie.
L'expansion du bassin rénal du fœtus peut être observée avec diverses anomalies chromosomiques. La fréquence des anomalies chromosomiques chez les fœtus atteints de pyéloectasie est en moyenne de 8 %. Chez la plupart des fœtus présentant des anomalies chromosomiques, une combinaison de pyélectasie et d'autres anomalies du développement est détectée. Une pyélectasie modérément prononcée a un bon pronostic et la nécessité d'un traitement chirurgical après l'accouchement est assez rare. Dans la plupart des observations, on note une résolution spontanée d'une pyélectasie modérément sévère après la naissance d'un enfant.
Les tactiques obstétriques dépendent du moment de l'apparition et de la durée de l'évolution du processus pathologique, ainsi que du degré d'altération de la fonction rénale. Un accouchement précoce est justifié par un oligohydramnios. Dans la période postnatale, une surveillance dynamique et une consultation avec un urologue pédiatrique sont présentées.
uropathie obstructive. L'obstruction des voies urinaires chez le fœtus peut être observée à n'importe quel niveau : obstruction élevée, obstruction au niveau de la fistule urétéro-pelvienne (PUR), obstruction au niveau moyen (uretère), obstruction au niveau de la jonction vésico-urétérale (VUR) , faible obstruction (urètre). L'URMS est la cause la plus fréquente d'uropathie obstructive chez le fœtus et représente en moyenne 50 % de toutes les anomalies urologiques congénitales. Les principales caractéristiques échographiques de l'OLMS comprennent la dilatation du bassinet du rein avec ou sans expansion des calices ; les uretères ne sont pas visualisés ; la vessie peut être de taille normale ou ne pas être visualisée dans certains cas. Les tactiques en OLMS doivent être attendues. La pose d'un shunt vésico-amniotique n'est pas indiquée. Au cri ultrasonique
Les OPMS chez le fœtus comprennent la dilatation de l'uretère et la pyélectasie. La vessie est généralement de taille normale. Les tactiques de direction sont similaires à celles de l'OLMS. La cause la plus fréquente d'obstruction basse est les valves urétrales postérieures. En cas d'obstruction sévère, on observe un oligohydramnios, entraînant une hypoplasie pulmonaire, des déformations des structures faciales et des membres, une fibrose et une dysplasie du parenchyme rénal. L'image échographique est caractérisée par la présence d'un urètre dilaté à proximité du site d'obstruction, une expansion prononcée de la vessie. La prise en charge prénatale de la faible obstruction dépend de la durée de la grossesse, de la présence d'oligohydramnios et d'anomalies associées, et de l'état fonctionnel des reins. Avec une pyélectasie modérément sévère et non progressive, des tactiques conservatrices doivent être suivies. Avec la progression des troubles obstructifs, l'accouchement avec correction chirurgicale éventuelle du défaut est justifié pour prévenir les troubles rénaux graves chez le fœtus. En cas de grossesse prématurée chez les fœtus atteints d'uropathie obstructive sévère, une correction chirurgicale intra-utérine du défaut peut être effectuée.
DÉFAUTS OSSEUX
Parmi les malformations congénitales du système squelettique, l'amélie (aplasie de tous les membres) est la plus fréquente ; phocomélie (sous-développement des membres proximaux, alors que les mains et les pieds sont directement reliés au corps); aplasie de l'un des os de la jambe ou de l'avant-bras inférieur; polydactylie (une augmentation du nombre de doigts sur un membre); syndactylie (réduction du nombre de doigts due à la fusion des tissus mous ou du tissu osseux des doigts adjacents) ; réglage d'arrêt anormal ; l'ostéochondrodysplasie, caractérisée par des anomalies de la croissance et du développement du cartilage et/ou des os (achondrogenèse, achondroplasie, dysplasie thanatoforme, ostéogenèse imparfaite, hypophosphatasie, etc.).
Le plus important est le diagnostic des malformations incompatibles avec la vie. De nombreuses formes de dysplasie squelettique sont associées à une hypoplasie pulmonaire due à la petite taille de la poitrine due au sous-développement des côtes. Le développement d'une insuffisance pulmonaire dans ce cas peut être la cause du décès d'enfants dans les premières heures de la vie extra-utérine.
Achondroplasie est l'une des dysplasies squelettiques non létales les plus fréquentes et est causée par une nouvelle mutation dans 90% des cas. L'achondroplasie est une ostéochondroplasie avec des défauts des os longs et/ou du squelette axial. La fréquence est de 0,24-5:10 000 naissances. Le ratio de fœtus mâles et femelles est de 1:1. Le raccourcissement des os dans l'achondroplasie peut ne pas apparaître chez le fœtus avant 24 semaines de gestation. Les signes échographiques classiques incluent des membres courts (inférieurs au 5e centile), une petite poitrine, une macrocéphalie et un nez en selle. L'espérance de vie avec l'achondroplasie dépend principalement du moment où la petite taille de la poitrine n'entraîne pas de problèmes respiratoires graves. Le développement intellectuel dans le défaut est normal, mais il existe un risque élevé de troubles neurologiques, en particulier une compression médullaire au niveau du foramen magnum, qui peut limiter exercice physique. La macrocéphalie peut être le résultat d'une hydrocéphalie légère due à la petite taille du foramen magnum. L'achondroplasie est un type bien étudié et courant de nanisme congénital chez les nouveau-nés. Problèmes graves, ils peuvent avoir une apnée centrale et obstructive du sommeil. À l'âge de 6-7 ans, on note souvent des infections chroniques récurrentes de l'oreille moyenne. Au début enfance il y a aussi souvent une courbure des membres inférieurs qui, dans des conditions sévères, nécessite une correction chirurgicale. Habituellement, la taille des adultes atteints d'achondroplasie varie de 106 à 142 cm.
BONJOUR! JE SUIS EN POSITION 32-33 SEMAINES. A LA DERNIERE DECOUVERTE ECHOGRAPHIQUE DU SNC DU FETUS : HYDROCEPHALIE, AGENESIE DU CALLOSUM, KYSTE ARCHOIDE. PETIT VSD DANS LE FŒTUS. PENDANT LA GROSSESSE, J'AI ÉTÉ À L'HÔPITAL 2 FOIS: POUR LA DURÉE DE 6-7 SEMAINES ET 28-29 SEMAINES AVEC DES MENACES DE TRAVAIL PRÉMATURÉ. PENDANT LA GROSSESSE, 3 DÉPISTAGES ONT ÉTÉ EFFECTUÉS, OÙ LE FŒTUS S'EST DÉVELOPPÉ NORMALEMENT SANS INDICATEURS DE CNS CM, ETC. SEULEMENT À 31-32 SEMAINES J'AI DÉCOUVERT UN TEL DIAGNOSTIC, QUI A ÉTÉ CONFIRMÉ PAR 3 SPÉCIALISTES AMÉRICAINS. DANS LA CAVITÉ UTÉRINE 1 FETUS EN PRÉSENTATION DE LA TÊTE. FETOMÉTRIE : BRG-79MM(32WEEKS) OG-285MM(31N.2DAY) JO 257MM(31N.) LONGUEUR DE L'HUMÉRUS DROIT ET GAUCHE 54MM-31WEEK. 6D. LONGUEUR DU FÉMURAL DROIT ET GAUCHE 56MM.-29SEMAINE 5 JOURS DL. ETC. ET NIV. SHIN BONES 51MM.-31SEMAINE DL. RADIUM OS 44MM.- 30 SEMAINES 6 JOURS POIDS ESTIMÉ DES FRUITS 1520 -+ 210GR. ANATOMIE DU FŒTUS : LES VENTRICULES LATÉRAUX DU CERVEAU SONT ÉLARGI, ASYMÉTRIQUES, LES CORNES DES VENTRICULES LATÉRAUX GAUCHE 17MM, DROITE 26MM. LE TROISIÈME VENTRICULAIRE EST DILATÉ À 10 MM. LA CAVITÉ DE LA CLOISON TRANSPARENTE N'EST PAS VISUALISÉE. EN COUPE SAGITTALE, LE CAL N'EST PAS SITUÉ DE FAÇON SIGNIFICATIVE. SUR LE CÔTÉ DE LA LIGNE MÉDIANE, À GAUCHE, À L'INTÉRIEUR DES POSTURES CRANIENNES ANTÉRIEURES ET MOYENNES, SE TROUVE UNE FORMATION DE STRUCTURE ANECHOGÈNE RONDE DE TAILLE 40*28 MM, AVASCULAIRE EN MODE CDI. GRAND RÉSERVOIR 6 MM. TAILLE INTERHEMISPHERE DU CERENERLUM 36 MM - 30 SEMAINES.3 JOURS. LE FUROUS DE SYLVIAN EST LOCALISÉ. STRUCTURES FACIALES : PROFIL - PAS DE CARACTÉRISTIQUES, TRIANGLE NOSOLABIQUE - PAS DE CARACTÉRISTIQUES. LARGEUR DU PROCESSUS ALVÉOLAIRE 27 MM. DIAMÈTRE ŒIL 15 MM, DIMENSION INTRAORBITALE 17,5 MM. COLONNE SANS DEFORMATION. POUMON SANS CARACTÉRISTIQUES. ÉCHOS DU FŒTUS. LE HAUT DU CŒUR EST SITUÉ DANS LE QUADRANT ANTÉRIEUR GAUCHE DE LA CAVITÉ POITRINE, LA BASE DE LA FRV EST À GAUCHE DU STERNUM. TAILLES DE CŒUR RÉGULIÈRES. Fréquence cardiaque 138 battements. EN MIN. AXE CŒUR À UN ANGLE DE 45 DEGRÉS PAR RAPPORT AU PLAN SAGITTAL. LES TAILLES DE L'ATRIUM SONT LES MÊMES, LA VALVE DE FORME OVALE OUVERTE DANS LA CAVITÉ DE L'ATRIUM GAUCHE FONCTIONNE. LES TAILLES DU VENTRICULE SONT LES MÊMES. DANS LE TIERS MOYEN DU MR LA ZONE ÉCHO-NÉGATIVE EST DE 1MM. LES SOUPAPES ATRIVENTRICULAIRES SONT SITUÉES AU MÊME NIVEAU ET FONCTIONNENT DE FAÇON SYNCHRONE. LA STRUCTURE DE LA MYOCARDIE, DE L'ENDOCARDIE ET DE LA PÉRICARDIE EST NORMALE. DES SECTIONS À COURT AXE À TRAVERS LES ARTÈRES PRINCIPALES ET UNE COUPE À TRAVERS 3 NAVIRES SANS CARACTÉRISTIQUES. EN MODE CFM DANS L'AORTE ASCENDANTE ET LES FLUX LAMINÉS DE L'ARTÈRE PULMONAIRE. ESTOMAC, VÉSICULE BILIAIRE, INTESTINS, REINS, FOIE - SANS CARACTÉRISTIQUES. LE LIEU DE FIXATION DU CORDON OMBILICAL À LA MUR ABDOMINALE AVANT EST SITUÉ. LE PLACENTA EST SITUÉ SUR LE MUR AVANT DE L'UTÉRUS, ATTEINT LE FOND. ÉPAISSEUR DU PLACENTA NORMAL-33MM. LE DEGRÉ DE MATURITÉ EST LE 1ER, QUI CORRESPOND À LA DATE DE LA GROSSESSE. LA QUANTITE D'EAU AMBIANTE EST NORMALE. LE CORDON OMBILICAL A 3 VAISSEAUX, RELIÉS DE FAÇON PARACENTRALE. PAROIS DE L'UTÉRUS SANS CARACTÉRISTIQUES. LA PERTURBATION DU FLUX SANGUIN UTERO-PLACENTAIRE ET FETUS-PLACENTAIRE N'EST PAS DETECTEE. QU'EST-CE QUE CET ENFANT A, À QUOI DOIS-JE M'ATTENDRE ET QUE FAIRE ?
Les malformations congénitales du fœtus comprennent les anomalies suivantes qui surviennent chez un enfant à naître :
Absence du cerveau (anencéphalie);
- forme ouverte de hernie de la moelle épinière (back bifida);
- malformations congénitales du système urinaire du fœtus ;
- maladie cardiaque chez le fœtus ou modifications pathologiques du système cardiovasculaire;
- diverses anomalies dans le développement des membres chez le fœtus - atrésie (absence de membres) ;
- fente labiale et palatine, autres déformations maxillo-faciales.
Pourquoi les malformations congénitales fœtales se produisent-elles
L'apparition et le développement de divers défauts chez le fœtus peuvent survenir sous l'influence d'un grand nombre de facteurs, dont la plupart sont restés jusqu'à présent inexpliqués.
Selon les signes étiologiques, toutes les malformations congénitales du fœtus sont divisées en:
Déviations dans les ensembles chromosomiques des parents (héréditaires);
- l'embryon ou le fœtus a été endommagé par une exposition à des pesticides, des médicaments ou des infections (tératogènes) ;
- influence conjointe sur l'enfant à naître de facteurs génétiques et environnementaux, qui individuellement ne peuvent pas être la cause du défaut (multifactoriel).
Selon certaines données, la pollution de la biosphère peut aussi être à l'origine de maladies dans 70% des cas, du développement de pathologies dans 60%, et de la mort d'enfants dans 50% des cas.
Les malformations congénitales du fœtus et le développement anormal ultérieur des enfants après la naissance sont également associés à activité professionnelle- si une personne subit un stress émotionnel pendant une longue période, une exposition à la poussière, à des niveaux élevés ou basses températures, constamment en contact avec les produits industrie chimique ou des sels de métaux lourds.
Également si future maman souffre d'une obésité importante, cela peut être une cause sérieuse d'anomalies dans le développement du tube neural du fœtus. De tels changements dans le petit corps du fœtus peuvent être causés non seulement par le poids excessif de la femme enceinte, mais aussi par sa forte diminution par premières dates grossesse.
malformations fœtales et grossesse ultérieure
De nombreux CM fœtaux sont traitables. Après la naissance, en fonction de l'anomalie existante, l'enfant subit les procédures nécessaires à sa correction ou à son traitement et poursuit une vie normale. Dans le cas où le CM du fœtus est incompatible avec la vie de l'enfant en dehors de l'utérus, la grossesse est interrompue. Six mois après cette procédure, vous pouvez planifier votre prochaine grossesse. Il y a des moments où un couple est conseillé d'attendre un an. Pendant ce temps, les futurs parents subissent certains tests et études génétiques, selon les résultats desquels le médecin déterminera quand il est possible de concevoir un enfant.
En préparation de la prochaine grossesse, le couple doit éviter l'influence de facteurs négatifs, mode de vie sain vie, prenez une multivitamine pour renforcer votre corps.
16769 0
Les malformations congénitales du fœtus occupent la 2ème-3ème place dans la structure des causes de mortalité périnatale, et leur fréquence a considérablement augmenté ces dernières années. À cet égard, le diagnostic précoce des malformations revêt une importance particulière, contribuant à la résolution rapide de la question de la possibilité d'une nouvelle prolongation de la grossesse, qui, à son tour, est déterminée par le type d'anomalie, la compatibilité avec la vie et le pronostic postnatal développement.
Classification des malformations courantes de la centrale système nerveux(CNS) peut être représenté comme suit :
1. Hydrocéphalie :
a) sténose de l'aqueduc cérébral ;
b) hydrocéphalie ouverte ;
c) Syndrome de Dandy-Walker.
2. Papillome du plexus choroïde.
3. Anomalies du tube neural :
a) le spina bifida ;
b) anencéphalie;
c) céphalocèle.
4. Microcéphalie.
Hydrocéphalie se produit avec une fréquence de 0,3 à 0,8 pour 1000 naissances vivantes. Dans la plupart des cas, l'hydrocéphalie congénitale est causée par une obstruction dans l'une des sections de la voie de circulation du liquide céphalo-rachidien (LCR). Souvent, l'hydrocéphalie est associée à d'autres anomalies : dans 37 % des cas, elle s'accompagne d'une autre pathologie intracrânienne - hypoplasie du corps calleux, céphalocèle, anomalies artério-veineuses, kystes arachnoïdiens ; anomalies extracrâniennes - dans 63%. Parmi ces derniers, malformations des reins (agénésies et dysplasies unilatérales et bilatérales), malformations cardiaques (communication interventriculaire, tétrade de Fallot), méningomyélocèle, dédoublement de la lèvre supérieure, du palais dur et mou, agénésie de l'anus et du côlon, gonades dysgénésie, syndrome de Meckele à noter. . Des anomalies chromosomiques sont retrouvées chez 11% des fœtus - trisomie 21 paires, translocations équilibrées, mosaïcisme.
L'hydrocéphalie est représentée par trois formes principales :
- sténose de l'aqueduc cérébral;
- hydrocéphalie ouverte;
- Syndrome de Dandy Walker.
Sténose de l'aqueduc du cerveau(SVM) est une forme d'hydrocéphalie obstructive causée par le rétrécissement de l'aqueduc sylvien. La fréquence spécifique de SVM atteint 43%, le ratio d'enfants de sexe masculin et féminin est de 1: 8. L'anomalie a un caractère polyétiologique : facteurs génétiques, infectieux, tératogènes et tumoraux, parmi lesquels prédominent les facteurs infectieux (50 %). Dans des études expérimentales, le rôle de la toxoplasmose, de la syphilis, de l'infection à cytomégalovirus, des oreillons et de la grippe a été confirmé.
Dans une certaine partie des observations, la cause de la sténose de l'aqueduc cérébral est pathologie génétique, qui peut être hérité dans un type récessif lié au chromosome X. L'hérédité liée au sexe est considérée comme une cause rare de WMS, car elle survient avec une fréquence de 1 cas pour 200 frères et sœurs de proposants atteints d'hydrocéphalie. Cependant, il est possible que ce type d'héritage soit de 25% chez les enfants de sexe masculin. On suppose que le gliome, le méningiome, la neurofibromatose et la sclérose tubéreuse entraînent une sténose de l'aqueduc due au mécanisme de compression et une hydrocéphalie ouverte - à la suite d'un œdème de la substance blanche et d'une compression externe. Des anomalies combinées surviennent chez 16 % des enfants.
Le diagnostic de cette forme d'hydrocéphalie repose sur la détection par ultrasons de l'expansion des ventricules latéral et III avec des dimensions inchangées du ventricule IV. Il est nécessaire de procéder à une analyse approfondie de la colonne vertébrale fœtale pour exclure les anomalies liées au sexe (Fig. 1).
Riz. 1. Grossesse 21 semaines. Hydrocéphalie obstructive
Prévision: la mortalité infantile varie de 11 à 30 % ; Développement intellectuel peut être normal.
Tactiques obstétricales: avant que le fœtus n'atteigne la viabilité, une interruption de grossesse est indiquée; lors de l'établissement d'un diagnostic aux stades ultérieurs, la méthode d'accouchement est déterminée uniquement par les indications obstétricales.
Hydrocéphalie ouverte(OG) - expansion des ventricules du cerveau et de son système sous-arachnoïdien à la suite de l'obstruction du système extraventriculaire des voies d'écoulement du liquide céphalo-rachidien.
L'hydrocéphalie ouverte est la deuxième plus fréquente, représentant 38 % de tous les cas d'hydrocéphalie. L'étiologie de l'OH n'a pas été clarifiée. L'OH est détectée chez les enfants présentant des anomalies de la colonne vertébrale et une oblitération du sinus sagittal antérieur, des hémorragies sous-arachnoïdiennes, un papillome du plexus choroïde et l'absence de granulations de Paccioni. L'hémorragie sous-arachnoïdienne est la cause la plus fréquente d'hydrocéphalie ouverte chez les nouveau-nés ; dans la période prénatale est extrêmement rare. Il est également rarement héréditaire, bien que la fréquence d'apparition atteigne 1 à 2%, ce qui est nettement plus élevé que dans la population générale.
Pathogénèse: l'obstruction mécanique du système extraventriculaire du cerveau et la mauvaise réabsorption du LCR entraînent l'expansion de l'espace sous-arachnoïdien, puis des ventricules cérébraux ; l'hydrocéphalie interne se développe dans le contexte d'une obstruction de l'aqueduc cérébral, due à une augmentation de la pression intracrânienne.
Le diagnostic prénatal de l'OH est réalisé à l'aide d'une échographie dynamique. Dans ce cas, le signe pathognomonique est l'expansion de la citerne sous-arachnoïdienne.
Prévision: le taux de mortalité atteint 11 %. La plupart des enfants survivants conservent une intelligence normale. Lorsque l'OH est associée à des anomalies du tube neural ou à un papillome du plexus choroïde, le pronostic est plus défavorable.
Tactiques obstétricales : dans les premiers stades de la détection de l'OH, l'interruption de grossesse est indiquée, avec une grossesse à terme, l'accouchement est effectué par le canal de naissance naturel.
Pour syndrome du dandy-walker une combinaison des anomalies suivantes est typique :
1) hydrocéphalie à des degrés divers ;
2) kystes de la fosse crânienne postérieure ;
3) défauts du vermis cérébelleux, à travers lesquels le kyste communique avec la cavité du ventricule IV.
Le syndrome survient chez 12% des enfants atteints d'hydrocéphalie congénitale. L'étiologie est inconnue. Ce syndrome peut être l'une des manifestations de maladies génétiques (syndromes de Meckel et Warburg), et également être détecté dans des aberrations chromosomiques (syndrome de Turner, 6p-, 9gh+, trisomie 9, triploïdie). Dans de rares cas, une transmission autosomique récessive est possible avec un risque de récidive allant jusqu'à 25 %.
Pathoembryogenèse. Selon la théorie de Dandy-Walker, l'atrésie des trous de Luschka et de Magendie conduit généralement à l'expansion du système ventriculaire. Le syndrome est une anomalie complexe du développement des structures médianes du cerveau dans la région de la fosse rhomboïde. Une hypoplasie du vermis cérébelleux et des kystes de la fosse postérieure surviennent secondairement, en raison de la compression par son ventricule IV fortement dilaté. Il existe également un déséquilibre dans la production de liquide céphalo-rachidien dans les ventricules latéraux, III et IV. Le défaut du ver cérébral varie d'une aplasie complète à une légère division. Malgré le fait que l'hydrocéphalie soit le principal signe diagnostique du syndrome de Dandy-Walker, la plupart des enfants ne l'ont pas au moment de la naissance, cependant, elle se manifeste dans les premiers mois de la vie d'un enfant.
Le syndrome est souvent (dans plus de 50% des cas) associé à d'autres malformations du système nerveux central (agénésie du corps calleux, encéphalocèle), des malformations des reins (polykystique) et du cœur (communication interventriculaire).
Diagnostique: cette anomalie est indiquée par la détection de formations kystiques dans la fosse crânienne postérieure lors de l'échographie ; un signe acoustique pathognomonique du syndrome est un défaut du ver du cerveau, à travers lequel le kyste communique avec le quatrième ventricule.
Prévision défavorable: la mortalité atteint 50%, 50 à 60% des enfants survivants présentent un retard de développement intellectuel.
Tactiques obstétricales : l'avortement à tout moment.
Papillome du plexus choroïde(PSS). Le néoplasme intracrânien survient avec une fréquence de 0,6 % de toutes les tumeurs cérébrales détectées chez les adultes et de 3 % chez les enfants. Le papillome peut être localisé dans n'importe quelle partie du système ventriculaire, mais se trouve plus souvent au niveau du vestibule des ventricules latéraux. La localisation unilatérale de la tumeur est caractéristique, bien qu'un processus bilatéral ne soit pas exclu. Le plus souvent, le PSS est représenté par un tissu de villosités, histologiquement similaire au tissu du plexus choroïde intact, et est bénin. Cependant, une malignité de la tumeur avec germination dans le tissu nerveux adjacent est possible. Le papillome du plexus choroïde est généralement associé à une hydrocéphalie.
Étiologie inconnu. Dans la pratique mondiale, des observations isolées de PSS sont connues chez des patients atteints du syndrome d'Aicardi (cette maladie est liée au chromosome X et se caractérise par une agénésie du corps calleux, des lacunes choriorétiniennes, des anomalies rachidiennes, une épilepsie et un retard mental).
Le PSS est diagnostiqué chez les enfants atteints d'hydrocéphalie lors d'une neurosonographie ou de radiographies. Dans l'enfance, la méthode de choix doit être considérée comme un contraste tomodensitométrie. L'échographie est la méthode la plus informative de diagnostic prénatal. Les critères échographiques du PSS sont l'asymétrie de la forme et de la taille des ventricules controlatéraux, la visualisation dans le vestibule des ventricules latéraux de formations faiblement échogènes adjacentes au plexus choroïde normal. En prénatal, le PSS des ventricules III et IV n'est pas détecté.
La méthode de choix pour la thérapie PSS est ablation chirurgicale tumeurs. Avec une nature bénigne du processus, le traitement chirurgical peut avoir un résultat favorable, mais l'opération est techniquement complexe et s'accompagne d'une perte de sang importante. Avec une lésion maligne (dans plus de 20% des cas), le pronostic est défavorable. La mortalité dans le PSS atteint 35% et 72% des enfants survivants présentent divers degrés de gravité de défauts de développement mental et mental.
Tactiques obstétricales : l'accouchement passe par le canal de naissance naturel; l'utilisation d'opérations d'accouchement vaginal est contre-indiquée. L'accouchement est recommandé dans les grands centres périnataux, où les soins d'urgence néonatologiques et neurochirurgicaux pédiatriques peuvent être dispensés. La question de l'utilisation de la césarienne pour réduire le risque de traumatisme à la naissance avec hémorragie intracrânienne n'a pas été définitivement résolue.
Conférences choisies sur l'obstétrique et la gynécologie
Éd. UN. Strizhakova, A.I. Davydova, L.D. Belotserkovtseva
Pertinence. Le diagnostic prénatal (PD) des malformations congénitales du fœtus est une composante extrêmement importante des soins prénatals, permettant de prévenir la naissance d'enfants atteints de malformations graves, incorrigibles, avec des maladies génétiques et chromosomiques mortelles socialement importantes. C'est le principal facteur de réduction de la morbidité, de l'incapacité et de la mortalité. De plus, la détection prénatale des anomalies cérébrales congénitales chez le fœtus affecte les tactiques obstétricales et réduit les conséquences psychologiques et sociales négatives pour la mère et pour la famille dans son ensemble, puisque les malformations congénitales (MC) du cerveau sont principalement des maladies graves et incurables. (un diagnostic précoce et de qualité des malformations du SNC peut prédire objectivement la situation et contribuer à bon choix tactiques de traitement). Ainsi, un diagnostic prénatal compétent, combiné à la collecte d'informations complètes visant à identifier divers facteurs de risque, permet au médecin et à la femme enceinte à haut risque d'aborder adéquatement la question de l'accouchement.
Méthodes, utilisé pour le diagnostic prénatal (prénatal), il est conseillé de diviser en indirect, lorsque l'objet de l'étude est une femme enceinte, et direct, lorsque le fœtus lui-même est examiné. Ce dernier peut être invasif et non invasif.
Les méthodes indirectes comprennent l'étude des antécédents obstétricaux et gynécologiques, le conseil génétique médical, ainsi que les études bactériologiques et sérologiques. Séparément, il convient de mentionner la conduite de tests de dépistage biochimiques visant à évaluer les niveaux de fœtoprotéine, d'œstriol, de gonadotrophine chorionique humaine, etc. Il convient de noter que l'objectif principal des méthodes indirectes est de sélectionner des femmes parmi les groupes à haut risque pour suivi approfondi déjà au niveau des centres de santé de la reproduction. Les principales indications pour orienter une femme enceinte vers la DP sont à peu près les mêmes partout dans le monde. Ceux-ci inclus:
[1
] âge de la femme supérieur à 35 ans ;
[2
] la présence d'au moins deux fausses couches spontanées(avortements) en début de grossesse ;
[3
] la présence dans la famille d'un enfant ou d'un fœtus issu d'une précédente grossesse atteint de la maladie de Down, d'autres maladies chromosomiques, avec malformations congénitales multiples, portage familial de remaniements chromosomiques ;
[4
] de nombreuses maladies monogéniques préalablement diagnostiquées dans la famille ou les proches parents ;
[5
] l'utilisation d'un certain nombre de préparations pharmacologiques avant et au début de la grossesse;
[6
] infections virales passées (hépatite, rubéole, toxoplasmose, etc.);
[7
] irradiation de l'un des conjoints avant la conception.
lire aussi l'article : Toxoplasmose(vers le site)
Les principales méthodes non invasives sont [ 1 ] échographie (échographie) examen (échographie) et [ 2 ] imagerie par résonance magnétique (IRM).
L'échographie du SNC et de la moelle épinière chez le fœtus est l'une des tâches les plus importantes et les plus responsables de l'échographie prénatale, car elle a un impact significatif sur l'optimisation des tactiques obstétricales et la décision des parents de prolonger ou d'interrompre la grossesse. Le moment optimal d'un examen échographique du fœtus pour exclure la plupart des malformations et des maladies du système nerveux central est :
[1
] 11 - 14 semaines de gestation ;
[2
] 19 - 21 semaines de gestation ;
[3
] 30 - 33 semaines de gestation.
Cela correspond aux étapes initiales de la manifestation de divers groupes de malformations et de maladies du système nerveux central, et assure également la continuité du diagnostic et des normes généralement acceptées de gestion de la grossesse et de l'accouchement. Dans le même temps, le schéma d'examen échographique du fœtus devrait inclure une évaluation de l'anatomie échographique du fœtus avec l'étude des os de la voûte crânienne, des principales structures du cerveau, de l'espace du col, du profil, des orbites, du nez os, orientation du cœur, de la colonne vertébrale, de la paroi abdominale antérieure, de l'estomac, des intestins, de la vessie et des membres.
Les données obtenues par un certain nombre d'auteurs témoignent de la grande valeur diagnostique de l'échographie dans le diagnostic prénatal des malformations congénitales, qui permet d'identifier plus de 80 à 90 % des malformations fœtales pendant la grossesse. Une partie importante de la pathologie macroscopique du développement fœtal peut être détectée au cours du premier trimestre, sous réserve du moment de l'examen et de toutes les exigences du protocole de dépistage pour l'évaluation de l'anatomie fœtale.
L'utilisation d'échographes modernes de classe experte, l'échographie transvaginale utilisant les modes 3/4D augmente considérablement la précision du diagnostic. L'étude du cerveau fœtal dans le plan sagittal médian, devenue pratiquement possible dans la plupart des cas à l'aide de l'échographie tridimensionnelle, permet une approche différenciée de l'évaluation de la norme et de la pathologie des structures cérébrales médianes. Les coupes axiales du cerveau fœtal utilisées en pratique échographique de routine ne permettaient pas d'obtenir une image claire du corps calleux. L'extension du protocole de la première étude de dépistage avec l'évaluation de la "transparence intracrânienne" a augmenté la précision du diagnostic de spina bifida au premier trimestre de la grossesse.
L'utilisation de la cartographie Doppler couleur pour la visualisation des vaisseaux cérébraux chez un fœtus au début de l'ontogenèse permet de manière fiable la visualisation d'un vaisseau fournissant une structure spécifique 2 à 5 semaines plus tôt que leur détection échographique standard déjà à la fin du 1er et au début du 2ème trimestre de grossesse. Une évaluation complète du développement des sulci et des espaces sous-arachnoïdiens permet de diagnostiquer une violation de la formation du cortex cérébral dès le deuxième trimestre de la grossesse. Des anomalies dans le développement du système nerveux central, telles que des violations de l'embryogenèse et de l'organogenèse fœtale précoce, peuvent être détectées à l'aide de l'échographie moderne jusqu'à 21 semaines de gestation. Dans le même temps, les signes échographiques de lésions destructrices et de formations volumétriques du SNC ne peuvent être diagnostiqués qu'aux II et III trimestres de la grossesse (S.M. Voevodin, 2012).
L'échographie transvaginale avec l'étude des structures anatomiques du fœtus avec échographie à 11-14 semaines de gestation est une méthode très informative de diagnostic prénatal en début de grossesse, qui permet de détecter plus de la moitié de toutes les malformations congénitales, qui sont graves dans la plupart des cas.
Il est également nécessaire de noter la valeur pour le diagnostic des malformations congénitales d'un signe ultrasonore tel que le polyhydramnios. La sévérité de l'hydramnios est corrélée à la fréquence des malformations congénitales du fœtus. Une relation directe a été établie entre liquide amniotique et l'incidence des malformations congénitales du fœtus.
En général, le succès du diagnostic dépend également du type de malformations congénitales (un certain nombre d'anomalies sont assez difficiles à diagnostiquer), de l'âge gestationnel auquel l'étude est réalisée, de la quantité de liquide amniotique et des caractéristiques constitutionnelles du patient. (l'obésité sévère crée des difficultés à l'examen transabdominal). D'autres facteurs qui rendent difficile l'interprétation correcte des résultats du dépistage peuvent être l'âge gestationnel, grossesse multiple, origine ethnique des parents, diabète chez la mère. Le diagnostic prénatal de l'agénésie du corps calleux (dont les principaux termes de détection sont les trimestres II-III de la grossesse), la hernie vertébrale est plutôt compliqué. Dans le même temps, malgré la grande précision et la simplicité relative des diagnostics échographiques de défauts absolument mortels tels que l'acranie et l'anencéphalie, certains d'entre eux sont détectés après 24 semaines de grossesse, ce qui peut indiquer une qualification insuffisamment élevée des médecins, le non-respect du dépistage conditions et méthodes d'examen. , orientation tardive des femmes vers le deuxième ou le troisième niveau d'examen. Un autre facteur négatif peut être le refus des femmes du caryotype prénatal. En outre, des problèmes tels que le diagnostic prénatal par échographie des malformations congénitales du système nerveux central tels que diagnostic différentiel avec de rares défauts.
L'IRM est une méthode très informative de diagnostic prénatal et peut être utilisée en cas de suspicion de malformations fœtales lors d'un examen échographique, en particulier en cas d'anomalies du SNC. Aux II et III trimestres de la grossesse, l'utilisation de l'IRM comme examen complémentaire améliore le diagnostic des anomalies du SNC et permet de préciser le diagnostic en cas de pathologie du cortex cérébral, des structures médianes du cerveau, de la fosse crânienne postérieure, et les troubles de la dynamique du LCR. L'IRM peut être utilisée avec succès dans les cas où les résultats de l'échographie ne sont pas suffisamment informatifs. Cependant, alors que l'IRM est en mesure de confirmer le diagnostic américain et de fournir des données plus détaillées, le coût relativement élevé, le manque de valeurs de référence standardisées et la disponibilité limitée de l'IRM sont les raisons pour lesquelles l'échographie reste l'étude de choix pour diagnostiquer la MC fœtale.
lire aussi article "IRM du cerveau fœtal: une revue" par S. Yazbek et P.E. Accorder. Neurographics, Volume 5, Numéro 5, 1er septembre 2015, pp. 181-191(11) [Partie 1] et [Partie 2]
À propos Une IRM est-elle sans danger pendant la grossesse ? tu peux lire
L'étude des protéines embryonnaires marqueurs dans le sérum sanguin de la mère. Ces dernières années, un rôle particulièrement important a été joué par l'étude des protéines embryonnaires marqueurs dans le sérum sanguin de la mère, telles que l'alpha-foetoprotéine (AFP), la gonadotrophine chorionique (hCG), l'estradiol libre et quelques autres. Le but de ces études est d'identifier les femmes à haut risque d'avoir des enfants atteints de malformations congénitales et héréditaires. Les modifications des marqueurs sériques sont typiques pour 90,9 % des femmes atteintes de malformations congénitales du système nerveux central. Menée au moment optimal (15-16 semaines de grossesse) à l'aide de trois systèmes de test, l'étude permet d'identifier jusqu'à 80% des fœtus présentant des défauts de développement des organes internes et jusqu'à 65% des maladies chromosomiques.
Le diagnostic prénatal en laboratoire des anomalies du tube neural repose principalement sur la détermination du taux d'AFP fœtale. Cette protéine est le composant principal du système protéique sérique fœtal et est déterminée au 30e jour de gestation. Une augmentation du niveau d'AFP dans le liquide amniotique est le signe d'une anomalie ouverte du tube neural. Au deuxième trimestre de la grossesse, l'échographie peut détecter de manière fiable une anomalie du cerveau fœtal. Étant donné que le fœtus et le placenta sont impliqués dans la formation d'estriol, le niveau d'estriol peut servir d'indicateur idéal du fonctionnement du système fœtoplacentaire. Plus le niveau de l'hormone est bas, plus la probabilité de développer une condition pathologique du fœtus est élevée.
Dans le même temps, l'interprétation de résultats isolés de tests biochimiques peut être difficile. Lors de l'examen des courbes de distribution des valeurs des principaux marqueurs, il existe une grande zone de chevauchement entre la norme et la pathologie, ce qui ne permet pas d'utiliser un seul marqueur, leur complexe complet est nécessaire: hCG, AFP et estriol.
Tests biochimiques au cours du premier trimestre de gestation, qui comprennent [ 1 ] détermination des concentrations de progestérone, [ 2 ] estriol non conjugué, [ 3 ] Fraction β de la gonadotrophine chorionique humaine (β-hCG) et [ 4 ] les protéines associées à la grossesse (7 - 8 ou 11 - 12 semaines) sont plus méthode efficace dépistage prénatal que le traditionnel "triple" test du deuxième trimestre, c'est-à-dire AFP, β-hCG, estriol - à 16 - 17 semaines de grossesse.
Malgré l'efficacité plutôt élevée des techniques modernes non invasives, des informations suffisamment complètes sur le caryotype de l'embryon, les caractéristiques biochimiques et génotypiques de ses cellules ne peuvent être obtenues que sur la base d'études appropriées des tissus du fœtus lui-même ou de son état provisoire. organes (placenta, chorion) obtenus de manière invasive à tout moment de la grossesse. L'amniocentèse est le plus souvent pratiquée pour détecter des anomalies chromosomiques et des mutations génétiques, mais le liquide amniotique peut également être utilisé pour diagnostiquer des anomalies du tube neural. Le plus fréquent risques possibles les procédures sont l'avortement spontané (0,5 % à 1,0 %), les saignotements après la procédure, l'infection, la rupture des membranes et les lésions ou pertes fœtales.
Le plus informatif est un examen complet des femmes enceintes utilisant des technologies ultrasonores modernes en combinaison avec un dépistage biochimique, ce qui augmente la précision du diagnostic des malformations congénitales du système nerveux central fœtal aux premiers stades du deuxième trimestre. De plus, la détection de signes d'hypoxie fœtale peut indiquer la présence possible non seulement d'une insuffisance fœtoplacentaire, mais également d'une pathologie congénitale, car l'hypoxie et le retard de croissance intra-utérin aggravent considérablement le pronostic de CM compatible avec la vie.
Faut se rappeler, Quoi anomalies congénitales du cerveau, détectées en période prénatale ou néonatale, sans compter les malformations externes non permanentes, [ !!! ] peuvent NE PAS présenter de symptômes cliniques spécifiques :
[1 ] dans les études neurosonographiques et de résonance magnétique, outre les formes nosologiques spécifiques des malformations congénitales du cerveau (syndrome de Chiari, syndrome de Dandy-Walker, hydrocéphalie occlusive, etc.), il faut prêter attention aux hypoplasies, beaucoup plus fréquentes ;
[2 ] en l'absence de diagnostic prénatal et néonatal par échographie et IRM, les conditions d'un diagnostic tardif apparaissent, pendant la période où les symptômes neuropsychiatriques arrivent en premier dans le tableau clinique, tandis que la présence d'un retard mental, l'hypertension intracrânienne peut servir de base à la réalisation d'un tel diagnostic. diagnostics comme la paralysie cérébrale, l'hydrocéphalie, etc.
lire aussi l'article : Neurosonographie : diagnostic échographique des lésions périnatales du SNC(sur laesus-de-liro.live-journal.com)
lire aussi l'article : Syndrome de Dandy-Walker(vers le site)
lire aussi l'article : Anomalie (malformation) Chiari type I(vers le site)
lire aussi l'article : Paralysie cérébrale(vers le site)
La valeur informative la plus élevée du syndrome convulsif indique la présence d'agénésie du corps calleux ou d'agyrie, le syndrome hypertensif-hydrocéphalique indique la présence d'hydrocéphalie congénitale et le syndrome des troubles moteurs indique la présence d'une hernie vertébrale.
Conclusion. Pour prévenir la naissance d'enfants présentant des anomalies du système nerveux central (tube neural), les méthodes suivantes sont actuellement utilisées : [ 1 ] test de dépistage primaire pour détecter les anomalies structurelles du fœtus, y compris une anomalie ouverte / fermée du tube neural (anencéphalie, encéphalocèle, spina bifida) - échographie du fœtus au deuxième trimestre de la grossesse ; [ 2 ] détermination des niveaux d'AFP sérique maternel; [ 3 ] conseil génétique des cas avec résultat de dépistage positif au moment des anomalies du tube neural (échographie + sérum maternel AFP) ; [ 4 ] IRM anténatale comme méthode complémentaire d'imagerie fœtale ; [ 5 ] amniocentèse diagnostique pour évaluer le caryotype du fœtus, déterminer le niveau d'AFP dans le liquide amniotique et l'activité de l'acétylcholinestérase ; [ 6 ] lors de la confirmation de la présence d'anomalies du tube neural chez le fœtus, la famille doit se voir proposer des options pour gérer une vraie grossesse - à la fois prolongation avec possibilité de correction pré- ou postnatale de l'anomalie et interruption de grossesse avec une anomalie incompatible avec la vie ; la méthode d'accouchement est choisie individuellement - il peut s'agir à la fois d'un accouchement naturel (vaginal) (en l'absence de contre-indications) avec surveillance du rythme cardiaque fœtal et d'un accouchement par césarienne; [ 7 ] consultations post-partum pour informer une femme sur la cause de la formation d'une anomalie du tube neural chez le fœtus, la possibilité de récurrence d'une telle affection chez le fœtus lors de grossesses ultérieures et la prévention, en particulier, la recommandation de prendre de l'acide folique à 5000 mcg par jour par les parents 3 mois avant la conception et pendant le premier trimestre de grossesse.