Le mot magique qui exauce les rêves n'existe pas seulement dans les contes de fées. Ça sonne juste comme de l'or. À la base, c'est un métal jaune ordinaire, grâce auquel il tire son nom. La question de savoir comment extraire l'or intéressait les gens il y a 7 000 ans, à la lointaine époque néolithique. C'est alors qu'il a commencé à acquérir une incroyable popularité en raison de sa couleur, associée au soleil et au pouvoir donné par les dieux. De nos jours, peu de gens le relient aux célestes, mais en tant que symbole de puissance et de richesse, l'or n'a pas seulement perdu sa signification, mais est également devenu la norme de l'économie, et avec elle l'indépendance politique de tous les pays.
Or dans la nature
Il est important de savoir non seulement comment extraire l'or, mais aussi d'où il vient sur notre planète. La réponse à cette question aide à comprendre où chercher ce métal convoité. Les scientifiques suggèrent que l'or se forme lors de l'explosion d'étoiles à neutrons, lorsque des tonnes de poussière sont projetées dans l'espace, contenant, avec d'autres métaux, de l'or. Par la suite, la poussière se concentre, formant des systèmes stellaires et des planètes. Ainsi en était-il de notre Terre. Maintenant, la majeure partie de l'or est dans son intérieur en fusion et "goutte à goutte" est projetée à la surface avec de la lave. C'est pourquoi les veines aurifères, où l'or peut être extrait relativement facilement, sont principalement situées dans des lieux de processus post-magmatiques et hydrothermaux. D'autres roches ignées, étant plus légères, sont lessivées avec le temps et l'or reste dans les placers. La même chose se produit avec l'or apporté sur Terre par les météorites. On peut le trouver sous sa forme pure (pépites d'or), ou dans certains minéraux, par exemple, dans les sulfures, les arséniures et 15 autres.
Propriétés de l'or
Avant de vous dire comment obtenir de l'or et à partir de quoi, familiarisons-nous avec ses propriétés. Cette connaissance aidera à ne pas perdre un seul milligramme de métal précieux lors de l'extraction. Quelles sont donc les propriétés de l'or ?
- Il est très dense et lourd. Une boule dorée d'un diamètre de seulement 5 cm pèse un kilogramme entier ! Cette propriété est utilisée dans la principale méthode d'extraction - le lavage.
- Il est très plastique, doux et, par conséquent, malléable. De l'or, vous pouvez faire des fils aussi épais qu'un cheveu humain et des plaques translucides plus fines que du papier. Cela permet de l'utiliser même dans les cartes SIM !
- Il peut fondre et bouillir, cependant, les températures doivent être assez importantes. Important : sous forme fondue, sans même attendre l'ébullition, l'or peut s'évaporer rapidement.
- Il est exceptionnellement inerte, c'est-à-dire qu'il ne se dissout pratiquement pas dans les acides (uniquement dans l'eau régale et dans plusieurs autres solvants).
Toutes ces propriétés de l'or sont utilisées dans les méthodes de son extraction à la fois dans la nature et à la maison. 
Où est extrait l'or
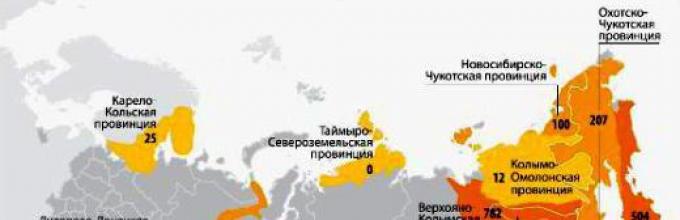
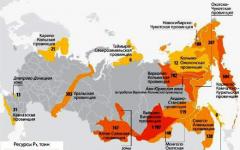
Il y a plusieurs pays dans le monde auxquels la nature a donné des gisements d'or. Il s'agit de la Chine (leader des mines d'or), de l'Australie, de la Russie, du Canada, des États-Unis, de l'Afrique du Sud, de l'ex-Ouzbékistan soviétique, du Pérou, du Brésil, du Mexique, du Chili, de l'Indonésie, du Ghana et de la Nouvelle-Guinée. L'extraction de l'or dans d'autres pays est également réalisée, mais en trop petites quantités. Notre pays se classe troisième après l'Australie et la Chine. Les citoyens russes s'intéressent sans aucun doute à l'endroit où l'or est extrait en Russie. Nous avons 37 entreprises engagées dans cette activité. Polyus Gold est le leader parmi eux. Près de 95% du volume total d'or se trouve en Extrême-Orient, dans les régions de l'Amour, de Krasnoïarsk, de Magadan, d'Irkoutsk, en Tchoukotka, dans le territoire de Khabarovsk, en Yakoutie (Sakha), en Bouriatie, en Transbaïkalie, à Tcheliabinsk et à Sverdlovsk Régions. Dans le même temps, la production maximale est réalisée dans le territoire de Krasnoïarsk et la dynamique maximale de son augmentation est observée dans les régions de Sverdlovsk et de Magadan et en Tchoukotka. Mais en Transbaïkalie, l'or est de moins en moins extrait. Parmi les mines et les gisements, on peut appeler Dome, Kyuchussky, Maisky, Karalveemsky, Vorontsovsky, Eldorado, Devil's creux, Sukhoi Log et autres. 
Fusion
C'est l'une des méthodes d'extraction de l'or les plus anciennes et les plus malsaines, officiellement interdite en Russie, mais utilisée dans d'autres pays et par nos orpailleurs. Il consiste en l'utilisation de mercure. Comment extraire de l'or avec la fusion? Pour ce faire, du mercure est ajouté à un plateau en plastique ou en verre contenant du sable et de très fines fractions d'or. Elle ne dissoudra pas le métal désiré, mais l'aspirera dans ses couilles. Pour faciliter le processus, vous devez faire pivoter le plateau, permettant au mercure de rouler sur toute la surface du sable. Les boules de mercure avec de l'or sont appelées amalgames. Il est recueilli, séparé du sable et soumis soit à un traitement à l'acide chlorhydrique, dans lequel le mercure se dissout, mais pas l'or, soit par évaporation du mercure au-dessus d'un feu. Vous pouvez le faire dans une simple poêle à frire. Dans l'acide, l'or débarrassé du mercure se dépose en flocons au fond, après quoi il est soigneusement lavé. Si vous ne souhaitez pas perdre de mercure, vous devez abaisser un morceau de papier d'aluminium dans l'acide. Cette technique simple permet au mercure de précipiter. Il est possible d'extraire l'or de l'amalgame en le filtrant simplement à travers du daim ou une bâche, mais la perte de métal coûteux est toujours importante. 
rinçage
C'est la méthode la plus ancienne et la plus respectueuse de l'environnement basée sur la haute densité de l'or. Le rinçage est utilisé aussi bien en production industrielle qu'en particulier, dans les gisements alluvionnaires. Il consiste à laver les roches avec de l'eau. Dans ce cas, toutes les particules légères sont éliminées et les plus lourdes, y compris l'or, restent au fond du plateau. L'inconvénient de cette méthode est que de trop petites particules d'or sont lavées à l'eau, ce qui réduit considérablement sa production. Certains se demandent si l'or peut être extrait par des particuliers. Oui, vous pouvez. En Russie, une loi a été adoptée permettant aux mineurs de travailler dans de petits gisements et des filons d'or épuisés. Pour ce faire, vous devez acheter une licence valable 5 ans.
Cyanuration
Cette méthode la moins laborieuse est basée sur la dissolution de l'or dans l'acide cyanhydrique. Comment extraire de l'or par cyanuration ? Il faut écraser la roche dans laquelle se trouve un métal noble, la verser dans un bac étanche, verser de l'acide cyanhydrique, notamment du cyanure de sodium. Il commencera à s'infiltrer à travers la roche, dissolvant l'or dans le processus. La solution résultante est versée dans un récipient séparé. L'or qu'il contient est précipité, par exemple avec de la poussière de zinc, et l'acide cyanhydrique est à nouveau renvoyé dans le processus. 
Flottation
Cette méthode ne peut pas être qualifiée d'extraction d'or pur, mais elle enrichit considérablement les roches et facilite la poursuite du processus. "Flotte", "flotteur" en traduction - c'est ce qui maintient à flot. Il s'avère qu'il y a des roches qui se mouillent bien et se déposent au fond, et il y en a qui ne se mouillent pas, mais qui ne sont enveloppées que de particules liquides, comme des bulles d'air, et grâce à cela, elles "flottent" à la surface . C'est la flottaison. Avec l'aide de celui-ci, l'or est extrait du sulfure, de l'or-pyrite, de l'or-cuivre et de certains autres minéraux. Le minerai est broyé, rempli d'eau et d'huile (par exemple, du pin), mélangé. Des particules d'or flottent à la surface. Dans l'industrie, au lieu du pétrole, l'air passe à travers un mélange d'eau et de minerai broyé, et d'autres réactifs. Une purification supplémentaire de l'or est le plus souvent effectuée par cyanuration.
Comment extraire de l'or à la maison
Les méthodes d'extraction industrielle de l'or sont bien sûr intéressantes, mais pour la plupart des citoyens, elles ne sont pas très pratiques. Tout le monde ne peut pas se permettre d'aller quelque part en Sibérie, dans des mines abandonnées. Oui, ce n'est pas nécessaire, car vous pouvez devenir prospecteur sans quitter les murs de votre propre appartement. Comment extraire de l'or à la maison ? Il existe plusieurs méthodes. La plus simple et la plus populaire depuis l'époque de l'Union est l'extraction des métaux précieux des montres et autres produits jaunes. Il s'avère qu'auparavant, en utilisant l'inertie de l'or, c'est-à-dire ses propriétés anti-corrosion, de nombreux objets métalliques en étaient recouverts. Bien sûr, le pourcentage d'or qu'ils contiennent est faible, mais dans les roches, il est également faible.
Ainsi, le minerai contenant seulement 5 à 10 grammes d'or par tonne est considéré comme riche. Que faire de l'horloge ? Collectez-en d'abord le plus possible. Ensuite, prenez un récipient inerte (verre, plastique), mettez-y la montre, remplissez-le d'acide nitrique et attendez qu'il dissolve tout sauf l'or. La solution résultante doit être filtrée à travers plusieurs couches de gaze et l'or déposé dessus doit être placé dans de la vodka et laissé reposer pendant une journée. Vous obtiendrez un précipité brunâtre. Puis rincez abondamment le tout à l'eau, filtrez à nouveau et mettez à fondre. Pour l'efficacité de cette dernière étape, de la soude est ajoutée à l'or en fusion. Il faut se rappeler que le métal désiré est capable de s'évaporer, mais lorsqu'il est fondu, les impuretés en excès le quittent et il se transforme lui-même en un petit lingot. 
L'or des composants radio
L'or est utilisé dans les circuits imprimés et les composants radio en raison de son inertie et de sa faible conductivité électrique. Comment obtenir de l'or à partir de composants radio et de microcircuits ? Pour cela, l'eau régale (un mélange d'acides nitrique et chlorhydrique), qui est préparée immédiatement avant le processus, convient. Ce mélange infernal dissout l'or à température ambiante. Il existe même un exemple historique de dissolution de médailles d'or dans de l'eau régale pour les cacher aux nazis. Le processus produit l'ion chloraurate, auquel du sulfite de sodium est ajouté. L'or doit précipiter. Il est filtré, lavé et fondu en lingot.

Avant de commencer le processus de dissolution, il est nécessaire de trier les pièces aurifères des autres. Ensuite, vous devez essayer de supprimer autant que possible tout ce qui est superflu des composants radio "corrects". Une attention particulière doit être portée aux pièces métalliques, telles que les chapeaux, les jambes. Si possible, ils doivent être collectés avec un aimant. Les planches peuvent être placées dans un mélange d'acide chlorhydrique et de peroxyde d'hydrogène dans un rapport de 2:1.
l'or de l'eau
Incroyable, mais vrai : l'or est contenu dans n'importe quelle eau, dont, théoriquement, il peut aussi être extrait. A quelle concentration est-il ? Il s'avère qu'environ 5 kg par km carré, et dans l'eau de mer, c'est plusieurs fois plus que dans l'eau du robinet. Il y a aussi une quantité relativement importante d'or dans l'eau de fonte qui s'écoule des montagnes et dans les sédiments limoneux, surtout minéralisés. On suppose que dans une tonne de limon de la mer Rouge - environ 5 g d'or. La principale façon de l'extraire est la suivante : ajouter de la chaux vive à l'eau, filtrer le précipité, renvoyer l'eau dans la mer ou la rivière et soumettre le sédiment à un traitement ultérieur, tel que la cyanuration.
or virtuel
Pour tous les joueurs qui se soucient du processus d'extraction de l'or lui-même, les informaticiens ont créé le jeu Minecraft, dont le but est de devenir un mineur prospère après avoir passé des dizaines de tests. Comment obtenir de l'or dans Minecraft ? Vous devez passer par plusieurs niveaux, "travailler" en tant que mineur, transformer le minerai extrait en lingots, et ensuite seulement l'utiliser pour fabriquer, par exemple, une armure de combat. Vous pouvez également chercher le métal désiré dans les anciens châteaux et donjons, "demander autour de vous" les gens qui se rencontrent sur les chemins difficiles des niveaux de passage. Pour les vrais mineurs d'or, cela semble être un amusement vide, mais le jeu Minecraft a conquis tous les continents sauf l'Antarctique, et a apporté tellement d'argent à ses développeurs que n'importe quel mineur envierait.
L'or dans l'eau n'est pas un mythe, mais une réalité qui n'a pas besoin d'être confirmée. Les ions du 79e élément du tableau de D. I. Mendeleev sont présents dans le corps humain, ils font partie des plantes et, bien sûr, de l'eau. Le liquide habituel est riche en métal précieux, il transporte de l'or, transporte ses particules au fond de la rivière, formant des dépôts. Cette qualité de l'eau intéresse les mineurs du monde entier qui explorent avec enthousiasme les rivières et les ruisseaux.
Trouver de l'or dans l'eau
Où et comment chercher Au?
L'or est extrait de l'eau en hiver comme en été. Cet élément peut être trouvé en utilisant plusieurs méthodes, et le temps froid n'arrêtera pas un prospecteur expérimenté. Pour commencer, il convient d'étudier l'algorithme des actions qui aideront à extraire le métal précieux de l'eau.
Alors, que faire pour ceux qui veulent trouver Au :
- Explorez la région, choisissez un endroit, discutez un peu avec les locaux. Des informations supplémentaires ne seront jamais superflues, c'est pourquoi il vaut la peine d'étudier attentivement la zone, de regarder des cartes et de collecter autant d'informations que possible. Une conversation avec les habitants aidera à établir où l'Au a été trouvé, il y a combien de temps.
- La teneur en or de l'eau peut agréablement surprendre et même plaire, mais pour en trouver, il ne faut pas plonger sous l'eau. Vous pouvez simplement explorer les rochers, examiner de grosses pierres, prélever un échantillon d'eau.
- À l'aide d'un plateau, vous devez prélever un échantillon de sable ou examiner la rive d'une rivière ou d'un ruisseau pour détecter la présence de cailloux de quartz. Le quartz est le principal compagnon de l'or, mais vous pouvez non seulement le rechercher, mais la pyrite et l'argent peuvent "accompagner" l'Au.
Comment obtenir de l'or et quels appareils peuvent être utilisés dans l'extraction de métaux précieux:
- L'eau contient des grains de sable Au, mais ils ne flottent pas avec le courant, mais rampent le long du fond. Au fil des années, les grains de sable sont pressés et peuvent se transformer en pépites et même en dépôts. Une mini-drague aidera à détecter le métal au fond. C'est un appareil qui fonctionne comme un aspirateur. La mini drague aspire le sable et aide à détecter Au. La machine elle-même filtre, rince et sépare l'or des impuretés et de la saleté.
- Un détecteur de métaux est un autre appareil qui aide à détecter les métaux précieux dans une rivière ou un ruisseau. L'appareil est immergé dans l'eau, il peut réagir à l'or et détecter un gisement à faible profondeur. Même avec l'aide d'un détecteur de métaux, explorez la zone côtière.
- Nos ancêtres utilisaient lors du lavage du plateau Au. Initialement, les appareils étaient fabriqués à partir de peaux de mouton, plus tard la technologie a changé. Les plateaux modernes sont utilisés pour travailler sur les rivières de montagne, les ruisseaux à débit rapide. Mais les progrès ne s'arrêtent pas et, malgré le fait que les plateaux modernes sont plus légers et plus pratiques, ils sont principalement utilisés pour prélever des échantillons d'eau.
La présence d'instruments aidera à accélérer la recherche et à augmenter les chances de succès. Mais cela ne signifie pas du tout qu'un équipement coûteux est une garantie à 100% de détecter une pépite dans le sol ou dans l'eau.
L'or dans le sable
L'obtention d'Au à partir de sable côtier commence par le fait qu'il est prélevé pour un échantillon : ils le lavent simplement dans un bac, en étudiant s'il y a des grains de métal jaune.
Vous pouvez déterrer plus de sable, le plonger dans des sacs et y verser de l'eau. Le fait est que le sable est beaucoup plus léger que l'or. Le métal noble se déposera immédiatement au fond et vous pourrez le voir, mais les grains de sable continueront à flotter dans le sac.

Schéma de l'emplacement possible de l'or dans le réservoir
L'eau avec du sable doit être filtrée, s'il n'y a rien à portée de main qui puisse être utilisé comme filtre, le liquide est simplement drainé. Elle repartira avec le sable, et Au restera au fond du sac.
Le métal précieux est extrait du sable exclusivement en été, en hiver, les prospecteurs recherchent simplement la zone côtière, examinent les pierres, mais ne lavent pas le sable.
Le plus souvent, le sable est simplement prélevé, il est soulevé du fond de la rivière ou creusé près du rivage. L'échantillon permet de déterminer s'il y a de l'Au à l'endroit choisi et quelle en est la quantité à cet endroit. Si vous parvenez à trouver plus d'un ou deux grains d'or, vous pouvez continuer la recherche. Si la quantité de métal jaune est négligeable, les chercheurs vont ailleurs.
A quelle profondeur peut-on trouver une pépite ?
- L'or ne pesant pas plus d'un gramme se trouve le plus souvent sous une couche de sable de 10-13 cm, il n'est pas si difficile de l'obtenir.
- Si vous soulevez le sol de 15 à 30 cm, il y a une chance de trouver une pépite pesant plus de 1,5 gramme.
- Si vous creusez le sol, qui va juste après le sable, vous pouvez trouver un morceau entier de métal précieux pesant plus de 100 grammes.
Cependant, l'extraction de l'Au est associée à certaines difficultés et rien ne garantit que les "excavations" aboutiront. Pour cette raison, il est recommandé d'étudier la zone avant de commencer la recherche et de prélever des échantillons de sol, de sable et d'eau.
Trouver de l'or dans l'eau de mer
L'extraction de métaux précieux de l'eau de mer présente certaines difficultés. Ils disent que si vous extrayez tout l'or des mers et des océans, son poids sera très décent. Mais aujourd'hui, il n'y a pas une seule méthode efficace qui aidera à extraire Au des eaux des océans et des mers. Mais il y a de l'espoir que bientôt les scientifiques pourront encore réussir dans cette affaire.
Les bactéries peuvent extraire l'or de l'eau de mer. Il n'y a pas si longtemps, on a découvert que les micro-organismes sont capables de détecter les particules métalliques, même s'il y a plusieurs grains d'Au par billion de mètres cubes d'eau.
Les bactéries précipitent les ions métalliques et les fixent ensemble, cela demande un certain temps aux micro-organismes.
Étant donné que cette méthode d'extraction est encore en cours de recherche, malgré toutes les perspectives, on peut difficilement la qualifier d'efficace.
En principe, les experts de nombreux pays se demandent depuis longtemps comment extraire l'Au de l'eau de mer. Il existe plusieurs méthodes, mais toutes sont considérées comme trop coûteuses et pour cette raison, elles ne sont pas utilisées dans l'industrie de l'extraction de l'or.
Bénéfice et perspectives
Peu importe où l'or est extrait, dans l'eau ou sur terre, l'industrie de l'extraction de l'or est maintenant considérée comme prometteuse.
Les volumes de production ne cessent de croître, les géologues recherchent de nouveaux gisements et les progrès technologiques ne s'arrêtent pas. L'invention de divers types d'équipements permet de relancer le développement de gisements jusque-là abandonnés et considérés comme peu prometteurs.
Le métal précieux est caché aux yeux de l'homme dans les couches de la roche, une grande quantité se trouve au plus profond des entrailles de la terre. L'or ne remonte à la surface que dans les lieux d'activité volcanique. Pour cette raison, depuis de nombreuses années, l'humanité réfléchit non seulement à la manière de l'extraire des entrailles de la terre, mais également à la manière d'extraire le métal précieux de l'eau de mer.
Dans le même temps, au fil des ans, l'amour des gens pour le métal jaune ne s'est pas affaibli. L'or attire et fascine, mais il n'y a pas que la beauté extérieure qui attire les mineurs et les banquiers.
Le métal précieux est un investissement rentable. Les cotations ne cessent de croître, et dans les conditions de la crise économique, la stabilité de l'or en attire beaucoup.
Sans aucun doute, l'industrie se développe et l'exploitation minière Au devient une activité rentable. Le métal est recherché non seulement par les employés des grandes entreprises, mais aussi par les voyageurs, les prospecteurs et simplement les gens ordinaires qui veulent résoudre des problèmes financiers ou s'amuser un peu.
Mais n'oubliez pas que la recherche de métal à un niveau professionnel nécessite des investissements matériels. Il faut acquérir du matériel, accéder à l'information et trouver le temps de le consacrer à la découverte des mines d'or. En moyenne, il faut au moins un an pour rechercher et développer un gisement.
Bien que l'on connaisse aujourd'hui au moins 60 éléments dissous dans l'eau de mer, seuls quatre sont extraits à l'échelle industrielle. Il s'agit du sodium, du chlore (sel de table ordinaire), du magnésium et de certains de ses composés, ainsi que du brome. Certains composés de calcium et de potassium sont extraits comme sous-produits du processus d'obtention du sel de table ou de l'extraction du magnésium. Habituellement, ces produits sont obtenus soit à la suite de l'extraction de l'eau de mer, soit lors du traitement des algues, en concentrant le calcium et le potassium. Cependant, il convient de noter que l'extraction industrielle de ces éléments directement à partir de l'eau de mer n'est pas encore maîtrisée. De nombreuses tentatives ont été faites pour extraire d'autres composés minéraux de l'eau de mer, mais l'extraction industrielle a échoué. De nombreuses méthodes ont également été brevetées pour extraire le sel de table, le magnésium et ses composés, le brome, l'iode, le potassium, le sulfate de calcium, l'or et l'argent de l'eau de mer (Baudin, 1916 ; Cernik, 1926 ; Niccali, 1925 ; S. O. Petterson, 1928 ; Vienne , 1949).
Extraction de sel
La production systématique de sel à partir d'eau de mer a commencé en Chine bien avant 2200 av. e. Pendant des siècles, de nombreux peuples ont été dépendants de la mer comme source de sel (Armstrong et Miall, 1946). Et maintenant, le sel, extrait de l'eau de mer par simple évaporation par la lumière du soleil, occupe une part importante dans le bilan total de la consommation de sel dans des pays comme la Chine, l'Inde, le Japon, la Turquie et les Philippines. Environ 6 millions de tonnes de sel sont produites chaque année dans le monde. En règle générale, la production de sel par évaporation de l'eau de mer nécessite un climat chaud avec des vents secs. Cependant, en plus de la proximité de la mer et du climat chaud, un certain nombre d'autres conditions doivent être réunies : faible perméabilité à l'eau du sol des bassins d'évaporation, présence de vastes zones basses situées sous le niveau de la mer ou inondées par la mer marées, de faibles précipitations pendant les mois d'évaporation active, l'absence d'effet diluant des eaux douces du fleuve et, enfin, en lien avec le faible coût de production du sel - la disponibilité de véhicules bon marché ou la proximité des marchés.
Environ 5% de tout le sel consommé par les États-Unis est produit par évaporation, principalement dans la région de la baie de San Francisco, où cette pêcherie a commencé dès 1852. Dans la fig. 5 montre des bassins d'évaporation artificiels près de l'extrémité sud de la baie de San Francisco. Ici, d'une superficie totale d'environ 80 m². miles "Leslie Salt Company" extrait chaque année environ 1,2 million de tonnes de sel. Des marais salants similaires se trouvent également dans les eaux d'amont des baies de Newport et de San Diego, dans le sud de la Californie; leur productivité annuelle est de 100 000 tonnes (Emery, 1960). Le rejet d'eau de mer dans les bassins d'évaporation près de la baie de San Francisco s'effectue pendant la période de hautes eaux à travers les vannes du barrage qui enferme le bassin de la mer. L'eau de mer y est vieillie jusqu'à ce qu'une partie importante de celle-ci s'évapore et que les sels qu'elle contient se fixent.

Riz. 6. Des grattoirs mécaniques sont utilisés pour enlever la couche supérieure de sel cristallisé. Au moment où la "récolte du sel" se produit, l'épaisseur de la couche de sel est généralement de 4 à 6 pouces.
Le sulfate de calcium cristallise à partir de la solution l'une des premières. Une fois les sels de sulfate de calcium déposés sur le fond, la saumure restante est soigneusement transférée dans la piscine de jardin où, en raison de l'évaporation, la solution s'épaissit encore jusqu'à ce que le chlorure de sodium commence à précipiter. L'évaporation de la saumure se poursuit jusqu'à ce qu'elle atteigne une densité d'environ 1,28, c'est-à-dire jusqu'au début du chargement des sels de magnésium. A ce stade, la saumure est appelée saumure mère amère. La saumure est retirée de la piscine de la cage et transportée vers d'autres entreprises, où divers composés de magnésium, du brome et d'autres sels en sont extraits. Une fois la saumure retirée, de la saumure fraîche est à nouveau versée dans le bassin de la cage et tout le cycle d'obtention de chlorure de sodium est répété. Au 1er août, une couche de chlorure de sodium de 4 à 6 pouces d'épaisseur s'accumule au fond de ces piscines. Le sel est échantillonné à l'aide de grattoirs mécaniques et de chargeurs (Fig. 6); puis le sel est lavé de diverses impuretés avec de l'eau de mer et stocké sous la forme de grands monticules en forme de cône (Fig. 7). Le sel à usage industriel n'est dans la plupart des cas pas raffiné davantage. Cependant, il est en outre purifié s'il est destiné à la consommation alimentaire de la population. La teneur en NaCl dans le produit raffiné dépasse 99,9 %. Le coût du sel obtenu par évaporation libre de l'eau de mer sous l'influence du soleil aux États-Unis varie de 10 $ pour 1 tonne de produit brut à proximité du lieu d'extraction à 150 $ pour 1 tonne de sel de table purifié et conditionné.

Le schéma d'extraction du sel de l'eau de mer est à peu près le même partout dans le monde, cependant, dans un certain nombre de pays, une main-d'œuvre bon marché permet de modifier ce processus.
Dans les pays au climat différent, comme la Suède et l'Union soviétique, le sel est obtenu en gelant l'eau de mer. La glace de saumure, qui est constituée d'eau presque pure, est filtrée de la saumure résiduelle, sur laquelle une série d'opérations de congélation successives sont ensuite effectuées avant que la concentration de ses parties résiduelles ne devienne suffisamment élevée pour commencer l'évaporation à sec sous l'action de l'eau artificielle. chauffage (Armstrong, Miall, 1946) .
La saumure concentrée restant après la séparation du chlorure de sodium est soumise à un traitement spécial supplémentaire afin d'extraire les composés qu'elle contient. Ainsi, l'ajout de chlorure de calcium à la solution provoque la prise de sulfate de calcium (gypse), qui est ensuite mis en vente. Avec une concentration supplémentaire de la saumure, des sulfates de magnésium, de potassium et d'autres sels précipitent. Dans les dernières étapes du procédé, le chlorure de magnésium et le brome sont récupérés de la solution résiduelle.
Extraction du brome de l'eau de mer
Le brome peut être considéré presque comme un élément marin, puisque 99 % de la teneur totale en brome de la croûte terrestre se trouve dans l'océan (voir tableau 2). Le brome a été découvert en 1825 par le chercheur français A. J. Balard dans des solutions concentrées obtenues après la précipitation du sel de l'eau des marais salants près de Montpellier. Plus récemment, du brome a été trouvé dans les gisements de potasse de Strasfurt et dans les saumures des forages du Michigan, de l'Ohio et de la Virginie-Occidentale. Le brome a été isolé pour la première fois de l'eau de mer en 1926 en Californie lors du traitement des saumures mères obtenues lors de l'extraction du sel dans des bassins d'évaporation artificiels. La consommation de brome par l'industrie était relativement limitée avant la production de moteurs à combustion interne à haute compression, de sorte que la demande du marché était satisfaite par les quantités extraites des saumures de forage et des gisements de sel. Mais ensuite, la situation a radicalement changé. Le dibromure d'éthylène a été ajouté à l'essence antidétonante contenant un additif de plomb tétraéthyle pour empêcher les dépôts de plomb sur les parois des cylindres, les soupapes, les pistons et les bougies d'allumage. Avec une telle augmentation de la demande de brome, les saumures pompées des forages se sont avérées insuffisantes. Ne satisfait pas la demande et l'extraction du brome comme sous-produit dans la production de sel. Il y avait un besoin urgent d'une autre source de brome.
Dans une recherche approfondie de sources supplémentaires de brome, Ethyl Corporation a développé un procédé pour précipiter directement le brome directement de l'eau de mer qui n'avait pas été préconcentrée. Selon ce schéma, le brome est précipité sous la forme d'un composé insoluble - la tribromoaniline - lorsque l'eau de mer est traitée avec de l'aniline et du chlore. Pour éviter l'hydrolyse du chlore, l'eau de mer est d'abord acidifiée avec de l'acide sulfurique. Plus tard, ce processus a été étendu à l'échelle de la production industrielle. L'unité a été installée sur un navire, qui a ensuite été converti en usine de récupération du brome. Fonctionnant 25 jours par mois, une telle usine flottante produit environ 75 000 livres de brome. Durant la même période, l'usine consomme des réactifs : 250 tonnes d'acide sulfurique concentré, 25 tonnes d'aniline, 66 tonnes de chlore, stockés entre les ponts supérieur et inférieur. L'efficacité de l'extraction du brome de l'eau de mer, où il ne contient que 0,1 livre par tonne, est d'environ 70 %. Le navire a mis en place des mesures de protection pour éviter la dilution de l'eau de mer avec les eaux usées rejetées après l'achèvement du processus. Plus tard, il a été découvert que les courants marins côtiers qui existent le long de nombreuses côtes peuvent être utilisés avec succès pour empêcher le mélange. À l'heure actuelle, on pense que d'un point de vue technique, le processus d'extraction du brome à bord d'une usine flottante a été résolu avec succès, mais travailler en haute mer avec des réactifs hautement corrosifs est beaucoup plus difficile que sur terre.
Le choix du site pour la construction d'une usine de récupération de brome doit être fait avec beaucoup de soin. Dans le même temps, il est nécessaire d'exclure à l'avance la possibilité de diluer l'eau de mer consommée par la plante avec des précipitations, des eaux usées, ainsi que de l'eau dont le brome a déjà été extrait. De plus, l'eau de mer doit avoir une salinité élevée et constante, une température relativement élevée, et ne doit pas être polluée par des déchets organiques, qui gaspillent du chlore. Un tel endroit qui satisfait à toutes les exigences ci-dessus a été trouvé près de Cure Beach (Caroline du Nord). Ici "Ethyl Dow Chemical Company" a construit une usine d'une capacité de 3 000 tonnes de brome par an. En 1938, la capacité de cette entreprise a été portée à 20 000 tonnes de brome par an (Shigley, 1951).
Une autre usine de ce type est construite près de Freeport, où les conditions d'extraction du brome de l'eau de mer sont plus adaptées à toutes les exigences technologiques que près de Cure Beach. La capacité nominale de cette usine est de 15 000 tonnes de brome par an. En 1943, une autre usine de même capacité y fut construite. L'entreprise près de Cure Beach a été fermée à la fin de la Seconde Guerre mondiale. Ainsi, les usines de Freeport produisent actuellement environ 80 % de la consommation annuelle de brome des États-Unis. Sur la fig. 8 est un schéma du procédé de récupération du brome pour la Ethyl Dow Chemical Company.

À l'usine de Cure Beach, selon une technique précédemment développée, un mélange d'eau de mer, d'acide et de chlore a été versé au sommet d'une tour en briques avec des grilles en bois intégrées. Le brome dissous dans l'eau de mer a été réduit par le chlore en brome élémentaire relativement volatil, et l'acide présent dans le mélange a empêché l'hydrolyse du chlore. Au fur et à mesure que le mélange brome-eau de mer s'écoulait du haut de la tour, l'air était soufflé de bas en haut. L'air qui passait transportait le brome libre hors de l'eau de mer et le transportait vers une tour d'absorption remplie de carbonate de sodium, après quoi l'eau de mer ne contenant plus de brome était renvoyée dans la mer. Une solution de carbonate de sodium saturée de brome a été traitée avec de l'acide sulfurique pour convertir les bromates et bromures de sodium en brome libre. Ensuite, le mélange a été pompé dans la colonne d'évaporation, où le brome a été distillé et recondensé dans des récipients en verre ou en céramique. Une purification supplémentaire du brome par distillation a permis d'obtenir finalement un produit avec une teneur en brome allant jusqu'à 99,7 %.
En 1937, ce processus a été quelque peu modifié. Ainsi, lors de la distillation primaire du brome, le dioxyde de soufre et l'air ont été utilisés comme supports. En conséquence, le brome a été libéré sous forme d'acide bromhydrique, ce qui a permis d'améliorer considérablement sa purification ultérieure. Bien que les deux procédés soient efficaces à plus de 90 % pour récupérer le brome, le procédé d'extraction directe du brome de l'eau de mer à l'aide de dioxyde de soufre est maintenant presque exclusivement utilisé aux États-Unis (Shigley, 1951).
Extraction du magnésium de l'eau de mer
Le magnésium est le plus léger des métaux utilisés dans la construction. Sa densité est de 1,74, celle de l'aluminium de 2,70 et celle du fer de 7,87. Ce métal est le plus largement utilisé dans la construction de véhicules. De plus, le magnésium est utilisé comme composant d'alliages avec l'aluminium, dans des systèmes de revêtements de protection anodiques et cathodiques, dans des lampes photo flash et dans de nombreux autres domaines technologiques. En 1964, la production mondiale annuelle de magnésium était d'environ 150 000 tonnes.
L'eau de mer contient environ 0,13 % de magnésium. Et malgré le fait que cette concentration ne représente que 1/300 de la quantité trouvée dans le minerai de magnésium extrait sur terre, l'eau de mer est la principale source de ce métal pour les États-Unis. Le magnésium a été extrait pour la première fois de l'eau de mer en Angleterre (Armstrong, Miall, 1946), mais la première grande entreprise d'extraction de magnésium de l'eau de mer a été construite près de Freeport au début de 1941 par la Ethyl Dow Chemical Company. Jusqu'à cette époque, le magnésium aux États-Unis était obtenu à partir de saumures de forage et de gisements de magnésite.

Le choix d'un site pour la construction d'une usine près de Freeport a été dicté par les circonstances très favorables suivantes. La disponibilité de gaz naturel bon marché permet de l'utiliser efficacement pour produire de la chaleur et de l'électricité. La situation géographique de l'usine permet de rejeter les eaux usées dans le golfe du Mexique, avec une possibilité extrêmement négligeable de diluer l'eau de mer consommée. De la chaux très bon marché peut être obtenue à partir de coquilles de chaux extraites du fond du golfe du Mexique, à quelques kilomètres seulement de l'usine de magnésium. Sur la fig. La figure 9 montre un diagramme de flux de processus pour l'extraction de magnésium dans une usine près de Freeport, et l'une des sections de cette usine est illustrée à la fig. dix.

Riz. 10. Vue générale de l'usine de traitement du magnésium de la Ethyl Dow Chemical Company, Freeport (Texac). Au premier plan, les épaississeurs Dorr sont visibles, dans lesquels un mélange d'eau de mer et de chaux est pompé afin d'accélérer la précipitation du chlorure de magnésium.
L'eau de mer entre dans l'usine à un débit d'environ 1 million de gallons par heure par les portes d'écluse sous-marines d'un canal relié au golfe du Mexique. L'avantage d'un tel système d'approvisionnement est que les couches d'eau inférieures ont une salinité beaucoup plus élevée que l'eau de surface dans la zone de l'usine. Dans une piscine artificielle, l'eau est traitée en continu avec du lait de chaux (il a été mentionné plus haut que la chaux est obtenue par calcination des coquilles d'huîtres). À la suite de la réaction du lait de chaux avec des composés de magnésium, un précipité liquide semblable à du limon d'hydroxyde de magnésium insoluble se forme, qui est ensuite pompé vers des bassins de décantation. Les sédiments représentent environ 2% du volume total d'eau de mer consommée dans cette production, en d'autres termes, dès la première étape du processus technologique, une concentration de 100 fois du composant utile est réalisée. Les eaux usées descendent dans la rivière Brasos, qui se jette dans le golfe du Mexique à une distance considérable de l'usine.
L'hydroxyde de magnésium filtré est dissous dans de l'acide chlorhydrique. La solution de chlorure de magnésium obtenue est concentrée par évaporation afin de se débarrasser partiellement des sels captés dans l'eau de mer. Le calcium est précipité sous forme de sulfate insoluble ou de gypse en ajoutant du sulfate de magnésium à une solution, après quoi la solution est à nouveau filtrée pour séparer le gypse et les autres sels, puis concentrée par évaporation. Lorsque la concentration en chlorure de magnésium atteint environ 50 % et que la température de la solution s'élève à environ 170°, celle-ci est pulvérisée sur le solide MgCl 2 préalablement séché. Le solvant se transforme instantanément en vapeur et le chlorure de magnésium est précipité. Le précipité solide séché est ensuite placé dans une chambre électrolytique où il se décompose en magnésium métallique et chlore gazeux. Le chlore est converti en acide chlorhydrique, qui est utilisé avec succès dans les cycles suivants du procédé. Le magnésium métallique est extrait de la chambre électrolytique et façonné en lingots. Leur teneur en métal dépasse 99,8 % (Shigley, 1951).
La demande globale des États-Unis en magnésium métallique brut et primaire est satisfaite depuis la fin de la Seconde Guerre mondiale par sa production à partir d'eau de mer. Pendant la guerre, le gouvernement américain a construit un certain nombre d'usines qui utilisaient de la magnésite, de la dolomite, des saumures pompées et de l'eau de mer comme matières premières pour la production de magnésium. Cependant, à la fin de la guerre, aucune de ces usines ne pouvait concurrencer les entreprises extrayant le magnésium de l'eau de mer, et ce malgré le fait que le gouvernement garantissait aux premières usines la pleine vente des produits, alors que les entreprises opérant à l'eau de mer n'avaient pas de telles garanties. .
Le choix du site pour la construction d'une usine de magnésium est déterminé par des exigences moins strictes qu'une usine qui reçoit du brome de l'eau de mer. L'exception, cependant, est le cas où le brome et le magnésium sont extraits ensemble. Ainsi, dans le processus d'extraction du magnésium, la température de l'eau de mer n'a pas une importance sérieuse, et la consommation de matières premières est moins importante : la production de 1 livre de magnésium élémentaire ne consomme que 5 % des quantités d'eau de mer qui sont utilisé dans l'extraction du brome. Les facteurs les plus importants qui déterminent l'opportunité de choisir un site pour une usine sont la proximité de sources de chaux, de combustible et d'électricité bon marché. L'efficacité du processus d'extraction du magnésium de l'eau de mer est de 85 à 90 %. Et bien que les capacités technologiques modernes permettent une extraction beaucoup plus complète du magnésium de l'eau de mer, cela n'est pas économiquement viable, car on estime qu'une augmentation du facteur de récupération de plus de 90% s'accompagne d'une forte augmentation des coûts d'investissement pour chaque pourcentage. augmenter.
L'un des avantages inhérents à ce procédé est que le faible coût des matières premières peut être encore réduit si ces matières sont introduites directement dans la chaîne de production en les pompant. Un tel approvisionnement mécanisé permet de rendre le processus de production largement continu et d'installer des dispositifs de contrôle automatique. De plus, une caractéristique positive d'une usine de ce type est l'extrême uniformité des matières premières qu'elle consomme.
composés de magnésium
Le magnésium sous forme de MgO, Mg(OH) 2 et MgCl 2 est largement utilisé dans une grande variété d'industries. Il est utilisé comme matériau réfractaire pour les revêtements intérieurs dans les fours de fusion, comme matière première pour la production pharmaceutique, dans les isolants, dans la production d'engrais, de rayonne et de papier, et bien plus encore. De nombreuses entreprises dans le monde obtiennent des composés de magnésium à partir de l'eau de mer ; en particulier, c'est typique de l'Angleterre et des États-Unis. Pour la première fois, l'extraction industrielle de composés de magnésium à partir d'eau de mer a été réalisée en tant que procédé secondaire à partir de saumures résiduelles dans la production de sel de table (Seaton, 1931 ; Manning 1936, 1938).

Riz. 11. La séquence du processus à l'usine de magnésium de la société "Kaiser Aluminium Eid Chemical" près de Moss Landing (Californie).
Le schéma du processus d'extraction des composés de magnésium de l'eau de mer est illustré à la fig. 11. Un tel schéma technologique est utilisé dans leurs entreprises de la Kaiser Aluminium and Chemical Corporation près de Moss Landing (Californie). L'eau de mer est mélangée à de la dolomie calcinée. L'hydroxyde de magnésium est précipité, qui est ensuite décanté dans de grands réservoirs de concentration. Après décantation, l'hydroxyde de magnésium est récupéré, lavé pour éliminer les impuretés solubles et filtré pour réduire la teneur en eau à environ 50 %. Une partie de l'hydroxyde de magnésium ainsi obtenu est commercialisée sous forme de gâteau de filtration homogénéisé sous forme de briquettes. Ces produits sont utilisés dans la fabrication d'isolants en papier et en magnésie. La partie du précipité restant sur le filtre est ensuite recalcinée pour former différentes qualités de MgO, qui peuvent être utilisées dans la production de rayonne, de caoutchouc, de revêtements isolants, de briques réfractaires. Sur la fig. 12 montre l'usine de composés de magnésium Kaiser.

Riz. 12. Usine d'extraction de magnésium de la compagnie d'eau de mer "Kaiser Aluminium End Chemical" près de Moss Leiding (Californie) (photo de l'avion).
Aux États-Unis, environ 90 % du volume total d'oxyde de magnésium calciné caustique et environ 50 % de la magnésie réfractaire sont obtenus à partir d'eau de mer ou de saumures pompées à partir de puits.
L'or de l'eau de mer
Tant d'efforts et d'argent ont été dépensés pour développer des méthodes d'extraction de l'or de l'eau de mer qu'il est difficile de comparer tout autre élément avec lui à cet égard. De nombreux brevets ont été délivrés sur des questions liées à l'extraction de l'or de l'eau de mer, tant en termes de méthodes que d'équipements (Bardt, 1927 ; Baudin, 1916 ; Bauer, 1912 ; Cernik, 1926 ; Bitter, 1938 ; Stoces, 1925). En 1866, l'un des membres de l'Académie française des sciences découvre la présence de traces d'or dans l'eau de mer. Et plus tard, en 1886, il a été signalé que la teneur en or dans les eaux de la Manche pouvait atteindre 65 mg par tonne d'eau.
Au début de ce siècle, Svante Arrhenius a souligné que les déterminations précédentes de la teneur en or de l'eau de mer étaient exagérées d'au moins 10 fois. Mais, néanmoins, les calculs d'Arrhenius lui-même ont montré que la teneur minimale en or dans l'eau de mer n'est pas inférieure à 6 mg par tonne 1. Selon ces calculs, environ 8 milliards de tonnes d'or sont contenues dans l'océan mondial. Cette quantité d'or est suffisante pour faire de chaque personne sur terre un millionnaire. Mais, malgré de nombreux brevets et projets, aucune quantité pratiquement tangible de ce métal n'a encore été obtenue à partir de l'eau de mer.
À la fin de la Première Guerre mondiale, le brillant chimiste allemand et lauréat du prix Nobel, le Dr Fritz Haber, a soutenu que la dette de guerre de l'Allemagne pouvait être payée avec de l'or extrait de la mer. En supposant que la concentration d'or est de 5 à 10 mg pour 1 tonne d'eau de mer, Haber a doté un navire de recherche avec le personnel et l'équipement appropriés pour étudier les teneurs en or les plus élevées dans les océans. Cependant, à son grand chagrin, Haber a constaté que les concentrations d'or dépassaient rarement 0,001 mg par 1 tonne d'eau (Haber, 1927). La teneur en or la plus élevée est notée dans l'Atlantique Sud et est de 0,044 mg par tonne 1. Même dans la baie de San Francisco, où coulent les rivières drainant les régions aurifères, la concentration d'or ne dépasse pas beaucoup la teneur moyenne de cet élément dans l'océan ouvert. Après 10 ans de travail sur ce problème, Haber est arrivé à la conclusion que l'extraction de l'or de l'eau de mer n'est pas rentable. Il est maintenant établi que les valeurs de Haber pour l'or dans l'eau de mer sont quelque peu inexactes, car il n'a apparemment pas pris en compte la présence d'or dans les produits chimiques et dans les récipients de réaction qu'il a utilisés lors de ses analyses.
Les méthodes d'extraction de l'or de l'eau de mer sont basées sur l'utilisation de particules de sulfure, qui ont une forte affinité pour l'or. Lorsque l'eau de mer passe sur ces particules, on pense que l'or adhère à la surface des sulfures. De plus, le mercure a également été proposé comme matériau pour extraire l'or de l'eau de mer.
Malgré de nombreuses tentatives pour extraire l'or de l'eau de mer, un seul cas est connu où des quantités tangibles de ce métal ont été obtenues. Dans le cadre de travaux approfondis dans une usine de récupération de brome en Caroline du Nord, la Ethyl Dow Chemical Company enquêtait sur l'extraction d'autres métaux, dont l'or. À la suite du traitement de 15 tonnes d'eau de mer, il a été possible d'extraire 0,09 mg d'or, dont la valeur est d'environ 0,0001 $. Aujourd'hui, cette quantité négligeable représente tout l'or qui a été extrait de l'eau de mer (Terry, 1964 ).
Autres substances extraites de l'eau de mer
Outre le sel habituel, le brome, le magnésium et ses composés, un certain nombre d'autres substances sont parfois extraites de l'eau de mer. Ce sont généralement des sous-produits de la production de sel ou ils sont obtenus par l'intermédiaire de certaines plantes ou de certains poissons.
Pour la première fois, l'iode a été découvert dans les cendres d'algues en 1811 par le Français Bernard Courtois, propriétaire d'une fabrique de salpêtre. À la recherche d'une matière première appropriée pour produire de l'alcali, il a décidé d'utiliser des algues à cette fin. En nettoyant les cuves de réaction, qui contenaient de l'acide sulfurique concentré chaud, il a attiré l'attention sur le dégagement de vapeurs violettes provenant des cendres d'algues. Les vapeurs se sont condensées sur les parois de la partie la plus froide du récipient sous la forme de cristaux sombres semblables à du métal (Armstrong et Miall, 1946). La teneur en iode de certaines algues, en particulier Laminaria, s'est avérée être d'environ 0,5 % sur une base sèche à l'air. La concentration d'iode dans l'eau de mer est d'environ 0,05 mg/l, soit environ 0,000005 %. Ainsi, dans ces types d'algues, 100 000 fois la concentration d'iode se produit par rapport à sa teneur dans l'eau de mer.
Peu de temps après la découverte de Courtois, l'importance de l'iode pour la médecine a été établie. Un développement intensif de l'industrie a commencé, principalement dans le nord de l'Angleterre, pour l'extraction de l'iode des algues. En 1846, il y avait plus de 12 usines à Glasgow qui extrayaient l'iode des algues. Cependant, la découverte d'iode dans les gisements de nitrate du Chili a entraîné une baisse de la production d'iode des algues.
À peu près à la même époque, des quantités importantes de sels de potassium et de sodium ont été extraites des algues. La technologie de ce processus, en substance, n'a pas été développée. Une simple lixiviation des algues avec de l'eau et une évaporation ultérieure de la solution résultante étaient généralement effectuées. Une autre méthode très courante de production de sels consistait à brûler les algues et à lixivier les cendres avec de l'eau. À la suite de ces processus primitifs, l'iode a été obtenu sous forme de composés - les iodures de potassium ou de sodium, qui, lorsqu'ils sont mélangés avec de l'acide sulfurique et du dioxyde de manganèse, ont été réduits en iode élémentaire.
Il y a trois périodes différentes dans l'histoire de l'utilisation des algues : a) la première - lorsque les algues ont été utilisées comme matière première pour la production d'alcali, b) la seconde - lorsqu'elles ont été utilisées pour extraire l'iode, et c) la troisième - lorsque la potasse a été extraite des algues. Cependant, chacune des périodes s'est terminée par la création de méthodes plus avancées pour obtenir ces produits à partir de matières premières moins chères extraites à terre. Actuellement, les algues sont utilisées comme matière première pour la production d'alginate de sodium, un composé organique utilisé comme agent gélifiant et émulsifiant dans la production alimentaire. De grandes entreprises transformant les algues comme matière première pour la production des composés chimiques en question sont situées sur la côte sud de la Californie. Dans de nombreuses régions du monde, en particulier à l'Est, les algues sont largement utilisées comme nourriture. Dans certains pays côtiers, ils sont utilisés comme engrais.
Extraction de composés minéraux lors du dessalement de l'eau de mer
Ces dernières années, une attention particulière a été portée au problème du dessalement de l'eau de mer. En règle générale, la concentration de sels dans les eaux usées dans ce cas est plusieurs fois supérieure à la teneur de ces sels dans l'eau de mer d'origine. Au cours de travaux sur l'extraction de composés minéraux de telles saumures, des résultats très encourageants ont été obtenus. Cela fait référence à une réduction du coût de pompage de l'eau entrant dans l'usine de traitement avec une température de saumure relativement élevée et une concentration environ 4 fois plus élevée.
Si le processus de dessalement de l'eau de mer s'avère rentable, la quantité de composés minéraux qui pourraient être récupérés des eaux usées sera plusieurs fois supérieure à la demande prévue. Supposons, par exemple, qu'au cours des prochaines décennies, la population des régions côtières atteindra environ 100 millions de personnes, qui utiliseront chaque année en moyenne 100 000 gallons d'eau par habitant à des fins domestiques et industrielles. Ce taux de consommation peut éventuellement atteindre une valeur d'environ 1013 gallons, ou 10 cu. milles d'eau par an. Avec la réception de ce volume d'eau de l'océan et l'efficacité d'extraction d'eau douce de 25%, 6,4 milliards de tonnes de chlorure de sodium, 240 millions de tonnes de magnésium, 160 millions de tonnes de soufre, 800 mille tonnes de bore, 2 mille tonnes d'aluminium, 400 tonnes de manganèse, 560 tonnes de cuivre, 560 tonnes d'uranium, 2 000 tonnes de molybdène, 40 tonnes d'argent et environ 1 tonne d'or. Nous supposerons qu'il est économiquement rentable d'extraire seulement 10% de ces quantités et que la population pour laquelle le dessalement de l'eau de mer a été réalisé est en mesure de consommer ces composants minéraux. Ensuite, sur la base des données statistiques placées dans le tableau. 3, on peut conclure que les taux d'extraction du molybdène, du bore et du brome correspondront à leur consommation, tandis que la production des autres composés minéraux dépassera largement la demande de ces substances. Bien sûr, il n'est pas nécessaire d'extraire tous les sels. Il est conseillé de se procurer uniquement les sels commercialisés. En tout état de cause, en raison de difficultés techniques, il est peu probable qu'il existe actuellement une extraction industrielle d'un élément dont la concentration dans l'eau de mer est inférieure à celle du bore. Cependant, les considérations suivantes méritent attention. S'il était possible d'extraire l'uranium et le thorium de l'eau de mer, l'utilisation de ces éléments dans des réacteurs de type surgénérateur fournirait l'énergie thermique nécessaire au fonctionnement des usines de conversion pour la production d'eau douce.
| Élément | Annuel produits, t |
Production par habitant population avec un général sa force 10 8 personne, t/an |
Contemporain consommation aux États-Unis par habitant population, t/an |
Attitude production à la consommation |
| NaCl | 64*10 8 | 64 | 0,145 | 440 |
| Magnésium | 2,4*10 8 | 2,4 | 25*10 -4 | 10000 |
| Soufre | 1,6*10 8 | 1,6 | 0,033 | 50 |
| Potassium | 68*10 6 | 0,68 | 0,010 | 68 |
| Brome | 1,2*10 6 | 0,012 | 4,7*10 -4 | 25 |
| Bor | 0,8*10 6 | 0,008 | 5,5*10 -4 | 15 |
| Aluminium | 2000 | 2*10 -5 | 0,013 | 0,001 |
| Manganèse | 400 | 4*10 -6 | 0,0033 | 0,001 |
| Cuivre | 560 | 7*10 -6 | 0,0067 | 0,001 |
| Uranus | 560 | 5*10 -6 | 1,4*10 -4 | 0,04 |
| Molybdène | 2000 | 2*10 -5 | 8,3*10 -5 | 24 |
| Argent | 40 | 6*10 -7 | 3,0*10 -5 | 0,02 |
| Nickel | 400 | 4*10 -6 | 0,001 | 0,004 |
| Or | 1 | 2*10 -9 | 5,0*10 -6 | 0,0004 |
De grands réacteurs nucléaires ont maintenant été conçus pour fournir de l'énergie thermique et électrique aux usines de dessalement par conversion (Hammond, 1962) dans les zones urbaines ou à des fins d'irrigation dans certaines zones. Une grande usine de réacteurs peut produire environ 109 gallons d'eau douce par jour ; ce montant devrait être suffisant pour répondre aux besoins domestiques et économiques d'une ville de 4 millions d'habitants ou pour irriguer des cultures d'une superficie de 500 mètres carrés. milles. Il est cependant difficile de s'attendre à ce que ces plantes deviennent de sérieuses sources d'approvisionnement en eau douce au cours des prochaines décennies. L'hypothèse concernant la consommation future des composants minéraux de l'eau de mer et la nature des variations des prix et des autres coûts est également insuffisamment étayée. En d'autres termes, les calculs statistiques placés dans le tableau. 3 n'ont qu'une valeur théorique.
N. V. Pertsov, 3. P. Ulberg, L. G. Iarochko, P. I. Gvoedyak, S 3 1 u4M lYa
"F Tumansky (7l) Candidat
Institut de Chimie des Colloïdes et Chimie de l'Eau (5A) MÉTHODE D'EXTRACTION DE L'OR DE L'EAU
L'invention concerne la chimie des colloïdes et peut être utilisée pour la purification de dispersions aqueuses et d'eaux usées à partir de solides en suspension, notamment d'or finement dispersé, dans les industries de l'extraction de l'or et de la joaillerie et d'autres entreprises de métallurgie non ferreuse.
Il existe une méthode connue pour extraire l'or de la roche à l'aide de bactéries, qui consiste en ce qu'elles transfèrent l'or dans une solution, d'où il est éliminé par la méthode d'échange d'ions O).
Cependant, des micro-organismes extraient l'or contenu dans la particule de roche, cultivant simultanément à sa surface, en l'absence de celle-ci, leur utilisation pour extraire, par exemple, l'or colloïdal d'une solution, n'entraîne pas d'effet. est l'impossibilité d'utiliser la méthode pour des solutions très diluées. La méthode est aussi très spécifique, complexe et longue.
Il existe également un procédé connu de traitement des eaux usées et de lavage, qui consiste à les filtrer sur des colonnes échangeuses d'ions, qui est basé sur le procédé de fixation d'ions métalliques ou de composés métalliques sous forme ionique, le plus souvent du dinka, du cuivre ou plus cher, par exemple or, particules d'ionite (2).
Cependant, cela ne retient pas les particules métalliques hautement dispersées, incl. or, dont la dispersion est de 200-300A. Lors du passage dans l'échangeur d'ions d'une solution contenant de l'or à l'état ionique de concentration 0,03 r/ë (sous forme de dicyanurate) et de l'or colloïdal 0,03 g/l, l'or à l'état ionique reste inférieur à 0,001 g/l, tandis que la teneur en or colloïdal change de 10-12F. En lavage
3 et les eaux usées des usines de bijoux et d'autres industries restent jusqu'à
15 mg/l d'or colloïdal, qui ne peut pas être éliminé par les méthodes existantes. La technologie d'échange d'ions prévoit la nécessité d'une étape de régénération associée à la consommation d'une quantité importante de sels, d'acides et d'alcalis, ainsi que du produit fini - de l'eau pure. Le pourcentage d'extraction de l'or colloïdal est de 10-143, et ionique
Le but de l'invention est d'augmenter le degré d'extraction de l'or de l'eau.
Cet objectif est atteint en introduisant des levures, genres Saccharomyces, ou Candida, dans de l'eau contenant de l'or à l'état colloïdal. ou des bactéries Rodotoru1a, ou Escher i chia, le mélange est de préférence conservé pendant 5 à 45 minutes, la phase dispersée est séparée et l'or est récupéré. Il est préférable d'introduire des micro-organismes à raison de 106-10 cellules/ml pour 1 mg/ml d'or.
La méthode se déroule de la manière suivante : 30
Des cultures de micro-organismes bien connus et utilisés sont utilisées - levure Saccha romyces ou Candida, ou Rodotorula, ou
Escherichia du 11.
Les cultures de levure sont cultivées pendant la journée sur de la gélose au moût et des bactéries - sur de la gélose à la peptone de viande, lavées avec une solution saline (10 4 mol / l NaC
b" 8 sur la cuvette du néphélomètre FZK-56 3.055, et le filtre lumière 6 est introduit dans une solution aqueuse d'or à la concentration de 0,030,24 mg/ml, conservée pendant
5-45 min, puis la phase dispersée est séparée par centrifugation ou électrorétention et l'or est récupéré, par exemple, en brûlant la masse résultante. La teneur en or est déterminée par. Spectrophotomètre UV utilisant une courbe d'étalonnage.
Le temps optimal est différent pour différents types de micro-organismes, par exemple pour Saccharomyces vini u Candida ,util!s 15 min, Rodotorulà glutinis—
30 min, et pour les bactéries Escherichia
coli - 45 min, de plus, la capacité des micro-organismes à s'agréger à l'or dépend de l'âge de la culture ° Par exemple, pour une culture de 4 jours, le temps de contact nécessaire augmente par rapport à une culture de 2 jours.
Exemple 1. A 50 ml d'eaux usées d'une fabrique de bijoux contenant de l'or colloïdal avec une concentration
0,03 mg/ml ajouter 50 ml d'une suspension de la culture de Saccharomyces vini à une concentration de 3°10 cellules/ml. Temps de contact 30 min. La masse résultante est centrifugée pendant 5 minutes à
5000 rpm, séparation de l'eau. La teneur en or de ce dernier est
0,001 mg/ml. En même temps, ils extraient
1,40 kg d'or.
Exemple 2. A 50 ml d'une dispersion aqueuse à 0,24 mg/ml d'or colloïdal, ajouter 50 ml d'une suspension d'une culture de Saccharomyces vlni de concentration 3.108 cellules/ml Le temps de contact est de 45 minutes La suspension est passé à travers une cellule d'électrorétention, qui se compose de la chambre de travail centrale et de deux chambres d'électrodes séparées des membranes de cellophane de travail.
La chambre centrale de la cellule est remplie de gel de silice granulaire. Dans la chambre de travail créer un champ électrique d'une force de 50 V/cm à un débit de 1,5 ml/min. Selon
Le spectrophotomètre UV est une extraction complète (rétention sur gel de silice) de l'or dispersé. Le tableau présente des données comparatives sur le degré d'extraction de l'or de l'eau par les méthodes proposées et connues.
La méthode permet d'extraire presque complètement (par 98-993) l'or hautement dispersé des solutions aqueuses et des eaux usées.
L'utilisation de la méthode proposée sur une seule fibre de bijoux fournira l'effet économique attendu de 50 à 60 000 roubles. par an, 948897
S C5 a c5 b-o
I5 x bx o x
С1 environ à environ environ.
Mer cd cd o o o
° ° m m une s je
U o c () x c co c
LA école o o o o o
° ° o o a o
SL CA o o o bb \ SS \ o o o o o
Oh oh oh oh
Compilé par G. Lebedeva
Editeur M. Tovtin Tekhred M. Nagy Correcteur G. Reshetnik
Ordonnance 5688/1
Circulation 981 Signé
VNIIPI du Comité d'État de l'URSS pour les inventions et les découvertes
113035, Moscou, N-35, Raushskaya nab., Succursale 4/5 de PPP "Patent", Uzhgorod, st. Conception, 4
La formule de l'invention est introduite dans l'eau à raison de 10 10 cellules/ml pour 1 mg/ml d'or.
1. La méthode d'extraction de l'or de l'eau - 3. La méthode selon les paragraphes. 1 et 2, à partir de couvercles, caractérisés en ce que, afin d'augmenter le degré d'extraction par les micro-organismes, l'eau est maintenue en courants, elle est d'abord introduite dans l'eau - nous 5-45 min. levure des genres Saccharomyces, ou Can- Sources d'information, dida, ou Rodotorula, ou bactéries prises en compte dans l'examen
Le processus de fusion et l'appareil pour extraire l'or de l'eau de mer sous forme métallique ont été proposés dès 1903.
L'eau de mer préfiltrée était pompée à travers un tube jusqu'au fond d'un récipient conique en forme d'entonnoir contenant du mercure et divisé par des tôles perforées en plusieurs sections (fig. 92). Après avoir été mis en contact avec le mercure, le flux d'eau ascendant était passé à travers une maille pour capter le mercure de la pierre ponce fine, puis à travers des feuilles de contact perforées, et enfin à travers un sas d'amalgamation situé au sommet de l'appareil et conçu pour capter complètement le mercure amalgamé. l'or du flux. L'amalgame a été traité par des méthodes conventionnelles (pressage, décapage et fusion).
Un appareil similaire a été proposé par Ritter1 et diffère en ce que le mercure fin et l'or qu'il contient, qui ont contourné la grille, sont capturés dans un dispositif ondulé.
Flottation ionique
Comme indiqué ci-dessus (voir chapitre IV), la flottation ionique est basée sur la capacité de certains composés hétéropolaires à interagir avec les ions de métaux lourds, et l'or en particulier, pour former un composé insoluble flottant. Les travaux les plus connus dans ce sens sont ceux relatifs à l'eau de mer de Sebba (Afrique du Sud) 189 J.
Absorption
L'un des premiers sorbants pour l'extraction de l'or de l'eau de mer a été testé sur des matériaux carbonés. Ainsi, au début du XXe siècle, Parker a découvert que les matériaux visqueux contenant du carbone, tels que l'asphalte, le bitume, le goudron minéral et autres, avaient une affinité pour l'or libre. Sur cette base, Parker a proposé de capter l'or finement dispersé (ou dit flottant) de l'eau de mer en le fixant sélectivement sur des lits solides et visqueux contenant du carbone déposés sur des barres et des bandes installées dans le cours d'eau. Assurer un contact continu de l'eau douce avec des matières visqueuses doit être assuré par l'action des marées de la mer.
Cependant, la plupart des chercheurs pensent que parmi les sorbants carbonés, les charbons actifs sont les plus intéressants pour la sorption de l'or de l'eau de mer.
Les pionniers de cette direction, les chercheurs allemands Nagel et Baur (1912-1913), ont proposé d'utiliser du coke, du charbon de bois et du charbon animal et quelques autres adsorbants pour la sorption de l'or de l'eau de mer. Dans les expériences, l'eau de mer après clarification préliminaire à l'aide d'un filtre à sable (pour éliminer les matières en suspension et les micro-organismes gélatineux) a été passée à travers un lit filtrant de coke, de charbon ou d'autres matériaux contenant du carbone en utilisant la méthode de percolation libre ou de filtration ascendante (Fig. 93). L'adsorbant enrichi a été périodiquement retiré et fondu.
Pour réduire le coût de pompage de l'eau de mer, il est proposé d'utiliser des conteneurs perforés avec un lit d'adsorbant à bord du navire, ou des cuves côtières avec un faux fond et une couche d'adsorbant recouverte d'un treillis métallique ou textile, rempli par l'action des marées.
En parallèle, en utilisant l'adsorbant classique (charbons actifs), des études ont été menées avec des sorbants inorganiques à surface très développée, tels que les hydroxydes fraîchement précipités (aluminium, fer, gel de silice), l'hydrocellulose coagulée, etc. Dans ce cas, il s'agissait ont proposé d'utiliser des bacs côtiers ou des sous-bocks spéciaux remplis d'un sorbant inorganique et entièrement recouverts d'une double couche de matière textile fibreuse. Les sous-verres sont immergés dans l'eau de mer pendant des semaines, voire des mois, après quoi ils sont traités avec des solutions de cyanure pour extraire l'or adsorbé. Les sous-verres plaqués or sont utilisés à plusieurs reprises.
Dans l'étude des méthodes de sorption possibles, il a été constaté que l'or métal colloïdal est préférable d'être extrait dans ce processus. Par conséquent, il était naturel de rechercher un sorbant qui réduirait simultanément l'or halogène à un état métallique et créerait une surface active fraîchement formée. En étudiant une large gamme de ces sorbants possibles, Parker est arrivé à la conclusion que pour l'extraction la plus complète de l'or de l'eau de mer, le sulfate ferreux est préférable, dont la consommation optimale est de 2 kg/t d'eau.
Par la suite, Parker a reçu un brevet séparé2 pour la conception matérielle de la méthode d'adsorption utilisant du sulfite ferreux.
La combinaison des processus de réduction d'halogénure et d'adsorption d'or colloïdal est également observée dans les propositions d'autres chercheurs. Ainsi, Bardt a recommandé de traiter l'eau de mer avec de la liqueur de sulfite (un déchet de la production de cellulose) comme agent réducteur, puis de la mélanger avec un mélange de charbon finement broyé et de métal pulvérisé (par exemple, cuivre, fer, etc.) 3. Le précipité contenant les métaux nobles a d'abord été brûlé (pour éliminer le carbone) puis fondu pour recueillir l'or dans le métal qui l'accompagne.
Un objectif similaire (récupération de l'or halogéné et capture complète de l'or colloïdal) a été poursuivi par Glazunov et ses collaborateurs (Paris, 1928), proposant d'utiliser des sulfures, et en particulier des pyrites, comme adsorbant pour l'or dissous dans l'eau de mer.
Cette idée n'a été pratiquement réalisée qu'en 1953 par Walthers et Stillman, qui ont suivi leur propre voie originale. Selon leur proposition, le minerai sulfuré était empilé derrière un mur de béton construit près de la ligne de marée inférieure et incurvé vers le rivage. À marée haute, le minerai était inondé d'eau et à marée basse, l'eau s'infiltrait à travers le minerai. Ce cycle a été répété plusieurs fois. Après un certain temps, la bouillie de sulfures décomposés contenant de l'or adsorbé a été retirée à marée basse et fondue. Les inventeurs ont constaté que la précipitation de l'or par les sulfures est facilitée par l'exposition de l'eau de mer aux éléments radioactifs.
Plus tard, Stokes a montré qu'une grande variété de matériaux sulfurés naturels et artificiels peuvent être utilisés pour précipiter l'or de l'eau de mer, le sulfure d'antimoine étant très efficace.
Pour intensifier le processus de sorption de l'or par les sulfures, tout en supprimant simultanément le coût du pompage de l'eau de mer, Gernick et Stokes ont proposé un appareil spécial d, appelé dans la littérature "piège à sulfure d'antimoine" (puisqu'il a été conçu pour être utilisé comme adsorbant, sulfure d'antimoine) ou "système d'énergie marémotrice". Ce dispositif est réalisé sous la forme d'un tuyau en forme de U inversé, dans un coude duquel est prévu un prolongement, dans lequel un adsorbant (charbon actif ou sulfures) est placé entre les grilles. L'eau de mer s'écoule dans ce tube sous l'influence d'un courant de marée ou lors du déplacement d'un navire, auquel l'appareil décrit est attaché.
Au cours des 10 à 15 dernières années, un certain nombre de brevets sont apparus qui améliorent l'extraction par sorption de l'or de l'eau de mer à l'aide de sulfures métalliques 2. L'idée et l'équipement les plus originaux dans ce sens ont été présentés par le chercheur américain Norris 3.
Sa dernière invention est basée sur l'utilisation de colloïdes de sulfure métallique fraîchement déposés adsorbés à la surface de fibres solides organiques, synthétiques ou naturelles. Un exemple typique de fibres organiques synthétisées est les fibres d'acrylonitrile polymérisé ou de cyanure de vinyle. Parmi les fibres naturelles, la fibre de ramie (ortie chinoise) est la plus appropriée. De telles fibres, lorsqu'elles sont immergées dans une fine suspension colloïdale (par exemple, du sulfure de zinc fraîchement précipité, préparé en mélangeant des solutions diluées de chlorure de zinc et de sulfure de sodium à un pH d'environ 6,0), adsorberont activement une partie importante des particules de sulfure colloïdal. et maintenez fermement sur leur surface. .
Lors du contact des fibres de sorption ainsi préparées avec des solutions pauvres en or (par exemple de l'eau de mer), des ions de métaux nobles sont adsorbés. Ils peuvent être éliminés des fibres par traitement avec des solutions diluées chauffées de cyanure de sodium avec une petite addition de peroxyde d'hydrogène ou d'hypochlorite de sodium avec une petite addition d'acide chlorhydrique. Après élution des ions adsorbés, les fibres peuvent être lavées et réutilisées plusieurs fois après prétraitement avec la bouillie de sulfure de zinc. En plus du sulfure de zinc, des sulfures de fer, de manganèse, de cuivre, de nickel et de plomb peuvent être utilisés dans ce procédé.
Des études à long terme de Norris ont établi que certains gaz oxydants, souvent dissous dans la plupart des eaux marines, peuvent nuire aux capteurs et aux fibres d'adsorption utilisés. Ces gaz comprennent l'oxygène, l'azote et le dioxyde de carbone. Par conséquent, pour obtenir le plus grand effet, l'appareil proposé doit disposer de moyens pour éliminer en continu ces gaz de l'eau de mer qui s'écoule avant qu'elle n'entre en contact avec la structure collectrice des fibres. De plus, en raison du nombre relativement faible d'ions métalliques qui sont collectés en une seule opération normale, ainsi que la complexité du traitement et de la manipulation de la masse de fibres, il est souhaitable d'effectuer toutes les opérations de manière continue et automatique. Tous ces facteurs ont été pris en compte dans l'appareil proposé par Norris (Fig. 94).
L'utilisation d'échangeurs d'ions naturels et artificiels pour extraire l'or et l'argent de l'eau de mer intéresse particulièrement les chercheurs.
La priorité dans cette direction revient à Brook, qui proposa en 1953 d'utiliser des zéolithes de fer et de manganèse pour extraire l'argent de l'eau de mer.
Plus tard, en 1964, Bayer et ses collègues (Allemagne) ont créé les soi-disant résines échangeuses d'ions chélates capables d'extraire jusqu'à 100% des métaux précieux de l'eau de mer.
Parmi les travaux les plus récents consacrés à l'utilisation des échangeurs d'ions solides pour l'extraction de l'or de l'eau de mer, l'étude d'un groupe d'expérimentateurs de la Gouffa Research and Development Company (USA) est la plus intéressante.
Pour la collecte des métaux nobles, il est proposé d'utiliser un polymère d'éthylène insoluble dans l'eau contenant des groupes carboxylate ou amide pendants. L'une des meilleures façons d'obtenir ce polymère est par saponification d'un copolymère d'éthylène acrylate d'alkyle ou par synthèse d'un copolymère d'éthylène et d'un ester de groupes acides comprenant les acides maléique, fumarique et taconique. La préparation de tels sorbants est décrite en détail dans le brevet.
Après avoir atteint un degré suffisant de chargement du film polymère, l'or adsorbé peut être extrait par fusion de la cendre après combustion du polymère ou précipité à partir de solutions issues de la dissolution de polymères dans de la soude caustique (soude caustique).
Les modes d'utilisation des échangeurs d'ions naturels et artificiels sont fondamentalement les mêmes que ceux des sorbants évoqués ci-dessus, à savoir : installation dans un courant d'eau de mer, filtration à travers un lit dans une cuve, chargement de récipients poreux.
Murro a proposé une toute nouvelle façon d'utiliser les échangeurs d'ions artificiels - en les appliquant à la coque d'un navire effectuant son voyage commercial. À son arrivée au port de destination, la résine échangeuse d'ions peut être extraite du navire et traitée. Le traitement de la résine consiste en un lavage avec des acides et des éléments spéciaux, suivi d'une électrolyse de l'éluat contenant des métaux précieux. Les résines régénérées peuvent être utilisées à plusieurs reprises.
La proposition la plus économique consiste à utiliser des dispositifs spéciaux situés dans la cale du navire et remplis de résines échangeuses d'ions. Ici, il est envisagé que le mouvement vers l'avant du navire amène l'eau de mer à s'écouler en continu à travers le navire avec l'échangeur d'ions. Ce navire devrait avoir une section transversale d'environ 9,5 à 10 m2, une longueur de 3 m et contenir environ 28 m3 de résine. Le débit maximal d'eau de mer lorsqu'elle est adsorbée sur la résine doit être de -0,8 m3 à 1 m2 de surface par minute (0,8 m/min).
A un tel débit, -12 500 tonnes d'eau de mer traverseront le dispositif de sorption par jour. Lorsqu'il est conservé dans l'eau, même
1 mg!t d'or par jour extraira 12,5 g d'or. Au cours d'une année de nage continue, environ 4,5 kg d'or, d'une valeur d'environ 5 000 $, peuvent être adsorbés.
Cimentation
L'un des rares rapports sur l'application pratique de la méthode de cimentation de l'or à partir de l'eau de mer fait référence à la méthode Parker brevetée aux États-Unis. La poussière de nickel est proposée comme métal de cimentation. Par réduction, substitution et adsorption, l'or peut être isolé de l'eau de mer, présent à la fois sous forme halogène et élémentaire.
Lors de la cémentation par mélange de poudre de nickel avec de l'eau de mer, il est possible d'atteindre sa charge en or de 15 à 20 % en poids. La poudre de nickel chargée est retirée de la cuve et fondue.
Pour précipiter l'or des eaux de mer très pauvres, Sneming a suggéré d'utiliser l'affinité accrue de l'or pour le tellure. Il a été établi qu'il est plus opportun d'effectuer un dépôt avec du tellure amorphe avec une surface de réaction très développée. Un tel agent de cimentation est obtenu en traitant un sel de tellure soluble avec du dioxyde de soufre. L'eau de mer est filtrée à travers une couche fixe de tellure amorphe. Pour extraire l'or précipité, la masse enrichie est chauffée pour sublimer le tellure (avec sa capture ultérieure), et le reste est fondu en or.