꿈을 이루는 마법의 단어는 동화에만 있는 것이 아니다. 그냥 금처럼 들립니다. 그 핵심은 이름을 얻은 덕분에 평범한 노란색 금속입니다. 7,000년 전 먼 신석기 시대에 사람들이 금을 추출하는 방법에 대한 질문. 그때부터 태양과 신이 준 힘과 관련된 색상으로 인해 놀라운 인기를 얻기 시작했습니다. 요즘 그를 천체와 연결하는 사람은 거의 없지만 권력과 부의 상징으로서 금은 그 의미를 잃지 않았을 뿐만 아니라 경제의 표준이 되었으며 모든 국가의 정치적 독립이 되었습니다.
자연의 금
금을 채굴하는 방법뿐만 아니라 그것이 우리 행성의 어디에서 왔는지 아는 것도 중요합니다. 이 질문에 대한 답은 이 탐나는 금속을 어디에서 찾아야 하는지 이해하는 데 도움이 됩니다. 과학자들은 금이 다른 금속과 함께 금을 포함하는 수많은 먼지가 우주로 던져질 때 중성자 별이 폭발하는 동안 금이 형성된다고 제안합니다. 그 후 먼지가 집중되어 별계와 행성을 형성합니다. 우리 지구도 마찬가지였습니다. 이제 금의 대부분은 녹은 내부에 있으며 "한 방울씩" 용암과 함께 표면에 던져집니다. 그렇기 때문에 비교적 쉽게 금을 채굴할 수 있는 금광맥이 주로 후마그마 및 열수 과정에 위치한다. 더 가벼운 다른 화성암은 시간이 지남에 따라 씻겨 나가고 금은 사금에 남아 있습니다. 운석이 지구로 가져온 금도 마찬가지입니다. 순수한 형태(금 덩어리) 또는 일부 광물(예: 황화물, 비화물 및 기타 15개)에서 찾을 수 있습니다.
금의 성질
금을 얻는 방법과 금을 얻는 방법을 알려주기 전에 그 속성에 대해 알아 봅시다. 이 지식은 추출 중에 1밀리그램의 귀금속을 잃지 않도록 도와줍니다. 그렇다면 금의 속성은 무엇일까요?
- 매우 조밀하고 무겁습니다. 직경이 5cm에 불과한 황금 공의 무게는 1kg입니다! 이 속성은 추출의 주요 방법인 세척에 사용됩니다.
- 그것은 매우 유연하고 부드러 우며 결과적으로 가단성입니다. 금으로 사람의 머리카락만큼 두꺼운 실과 종이보다 얇은 반투명 판을 만들 수 있습니다. 이것은 SIM 카드에서도 사용할 수 있습니다!
- 그것은 녹고 끓을 수 있지만 온도는 상당히 중요합니다. 중요: 녹은 형태로 끓일 때까지 기다리지 않고도 금이 빠르게 증발할 수 있습니다.
- 그것은 비정상적으로 불활성입니다. 즉, 실제로 산에 용해되지 않습니다 (왕수 및 기타 여러 용매에만).
금의 이러한 모든 특성은 자연과 가정에서 추출하는 방법에 사용됩니다. 
금은 어디에서 채굴됩니까?
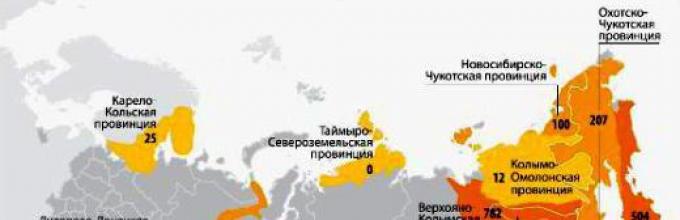
세계에는 자연이 금 매장지를 부여한 여러 국가가 있습니다. 이들은 중국(금 채굴의 선두주자), 호주, 러시아, 캐나다, 미국, 남아프리카, 구소련 우즈베키스탄, 페루, 브라질, 멕시코, 칠레, 인도네시아, 가나, 뉴기니입니다. 다른 나라의 금 채굴도 수행되지만 너무 적은 양입니다. 우리나라는 호주와 중국에 이어 3위입니다. 의심 할 여지없이 러시아 시민들은 러시아에서 금이 채굴되는 곳에 관심이 있습니다. 우리는 이 사업에 종사하는 37개의 회사를 가지고 있습니다. Polyus Gold는 그 중 선두 주자입니다. 금 총량의 거의 95%는 극동, 아무르, 크라스노야르스크, 마가단, 이르쿠츠크 지역, 추콧카, 하바롭스크 영토, 야쿠티아(사하), 부랴티야, 트란스바이칼리아, 첼랴빈스크 및 스베르들로프스크에 있습니다. 지역. 동시에 Krasnoyarsk Territory에서 최대 생산이 이루어지며 Sverdlovsk 및 Magadan 지역과 Chukotka에서 최대 생산량 증가가 관찰됩니다. 그러나 Transbaikalia에서는 금이 점점 더 채굴됩니다. 광산 및 매장지 중에는 Dome, Kyuchussky, Maisky, Karalveemsky, Vorontsovsky, Eldorado, Devil 's trough, Sukhoi Log 등이 있습니다. 
융합
이것은 러시아에서 공식적으로 금지된 가장 오래되고 가장 건강에 해로운 금 채굴 방법 중 하나이지만 다른 국가와 우리의 금광 장인들이 사용합니다. 그것은 수은의 사용으로 구성됩니다. 합병으로 금을 채굴하는 방법? 이를 위해 모래와 매우 미세한 금 조각이 들어 있는 플라스틱 또는 유리 쟁반에 수은을 추가합니다. 그녀는 원하는 금속을 녹이지 않고 공에 끌어들입니다. 프로세스를 돕기 위해 트레이를 회전시켜 수은이 모래 표면 전체를 굴릴 수 있도록 해야 합니다. 금으로 된 수은 공을 아말감이라고 합니다. 그것은 수집되어 모래에서 분리되고 수은은 용해되지만 금은 아닌 염산 처리를 받거나 불로 수은을 증발시킵니다. 간단한 프라이팬으로 할 수 있습니다. 산에서 수은이 제거된 금은 바닥에 박편으로 가라앉은 후 완전히 씻겨집니다. 수은을 잃고 싶지 않다면 호일 조각을 산에 넣어야합니다. 이 간단한 기술로 수은이 침전됩니다. 아말감에서 스웨이드나 타포린으로 간단하게 여과하여 금을 추출할 수 있지만 값비싼 금속의 손실은 항상 큽니다. 
홍조
이는 고밀도 금을 기반으로 한 가장 오래되고 환경 친화적인 방법입니다. 플러싱은 산업 생산 및 개인의 충적 퇴적물 모두에서 사용됩니다. 그것은 물로 바위를 씻는 것으로 구성됩니다. 이 경우 가벼운 입자는 모두 제거되고 금을 포함한 무거운 입자는 트레이 바닥에 남습니다. 이 방법의 단점은 너무 작은 금 입자가 물로 씻어내어 생산량이 크게 감소한다는 것입니다. 일부는 개인이 금을 채굴할 수 있는지 여부에 관심이 있습니다. 그래 넌 할수있어. 러시아에서는 광부들이 작은 광상과 폐금 광맥에서 일할 수 있도록 허용하는 법이 통과되었습니다. 이렇게 하려면 5년 동안 유효한 라이센스를 구입해야 합니다.
시안화
이 최소한의 노동 집약적 방법은 시안화수소산에 금을 용해시키는 것을 기반으로 합니다. 시안화로 금을 채굴하는 방법? 귀금속이있는 암석을 부수고 방수 트레이에 붓고 시안화 수소산, 특히 시안화 나트륨을 부을 필요가 있습니다. 그것은 바위를 통해 스며들기 시작할 것이고, 그 과정에서 금을 녹일 것입니다. 결과 용액을 별도의 용기에 붓습니다. 그 안에 포함된 금은 예를 들어 아연 분진으로 침전되고 시안화수소산은 다시 공정으로 되돌아갑니다. 
주식 상장
이 방법은 순금 채굴이라고 할 수는 없지만 암석을 상당히 풍부하게 만들고 추가 프로세스를 용이하게 합니다. 번역에서 "Fleet", "flotter"- 이것이 떠 다니는 것입니다. 잘 젖어 바닥에 가라 앉는 암석이 있고 젖지 않고 기포와 같은 액체 입자로만 싸여있는 암석이있어 표면에 "부유"합니다. . 이것은 부양입니다. 그것의 도움으로 금은 황화물, 금-황철석, 금-구리 및 기타 광물에서 채굴됩니다. 광석은 분쇄되고 물과 기름 (예 : 소나무)으로 채워지고 혼합됩니다. 금 입자가 표면에 떠 있습니다. 산업계에서는 물과 분쇄된 광석의 혼합물을 통과하는 공기와 일부 다른 시약을 오일 대신 사용할 수 있습니다. 금의 추가 정제는 대부분 시안화에 의해 수행됩니다.
집에서 금을 채굴하는 방법
물론 산업 금 채굴 방법은 흥미롭지 만 대부분의 시민에게는 그다지 실용적이지 않습니다. 모든 사람이 시베리아 어딘가에 버려진 광산으로 갈 여유가 없습니다. 예, 자신의 아파트 벽을 떠나지 않고도 광부가 될 수 있기 때문에 이것은 필요하지 않습니다. 집에서 금을 채굴하는 방법? 몇 가지 방법이 있습니다. Union 시대 이후 가장 쉽고 가장 인기있는 것은 시계 및 기타 노란색 제품에서 귀금속을 추출하는 것입니다. 이전에는 금의 불활성, 즉 부식 방지 특성을 사용하여 많은 금속 물체가 금으로 덮여 있음이 밝혀졌습니다. 물론 금의 비율은 적지 만 암석에서도 적습니다.
따라서 톤당 5-10g의 금만 포함된 광석은 풍부한 것으로 간주됩니다. 시계는 어떻게 해야 할까요? 먼저 가능한 한 많이 수집하십시오. 그런 다음 불활성 용기 (유리, 플라스틱)를 가져다가 거기에 시계를 넣고 질산으로 채우고 금을 제외한 모든 것이 녹을 때까지 기다리십시오. 생성 된 용액은 여러 층의 거즈를 통해 여과되어야하며 그 위에 증착 된 금은 보드카에 넣고 하루 동안 방치해야합니다. 갈색 침전물이 생깁니다. 그런 다음 물로 모든 것을 철저히 헹구고 다시 여과하고 녹이도록 설정하십시오. 이 마지막 단계의 효과를 위해 녹는 금에 소다를 첨가합니다. 원하는 금속은 증발 할 수 있지만 녹으면 과도한 불순물이 떠나고 그 자체가 작은 주괴로 변한다는 점을 기억해야합니다. 
라디오 부품의 금
금은 비활성 및 낮은 전기 전도성으로 인해 회로 기판 및 라디오 부품에 사용됩니다. 무선 구성 요소 및 미세 회로에서 금을 얻는 방법은 무엇입니까? 이를 위해 공정 직전에 준비되는 왕수(질산과 염산의 혼합물)가 적합합니다. 이 지옥의 혼합물은 상온에서 금을 녹입니다. 나치로부터 금메달을 숨기기 위해 왕수에 녹인 역사적 사례도 있습니다. 이 공정은 아황산나트륨이 첨가된 클로라우레이트 이온을 생성합니다. 금은 침전되어야 합니다. 여과, 세척 및 용융되어 잉곳이 됩니다.

용해 과정을 시작하기 전에 금 함유 부품을 다른 부품에서 분류해야 합니다. 다음으로 "올바른" 무선 구성 요소에서 가능한 한 불필요한 모든 것을 제거해야 합니다. 모자, 다리와 같은 금속 부품에 특별한 주의를 기울여야 합니다. 가능하면 자석으로 수집해야 합니다. 보드는 염산과 과산화수소의 비율이 2:1인 혼합물에 놓일 수 있습니다.
물에서 금
믿을 수 없지만 사실입니다. 금은 이론적으로 추출할 수 있는 모든 물에 포함되어 있습니다. 어떤 농도에 있습니까? 평방 킬로미터 당 약 5kg이며 해수에서는 수돗물보다 몇 배 더 많습니다. 또한 산에서 흘러내리는 녹은 물과 미사 퇴적물, 특히 광물화된 금의 양이 상대적으로 많습니다. 홍해 미사 1톤에 약 5g의 금이 있다고 가정합니다. 그것을 추출하는 주요 방법은 다음과 같습니다: 물에 생석회를 첨가하고, 침전물을 걸러내고, 물을 다시 바다나 강으로 배수하고, 침전물을 시안화와 같은 추가 처리에 적용합니다.
가상 금
금 채굴 과정 자체에 관심이 있는 모든 도박 사용자를 위해 컴퓨터 과학자는 수십 개의 테스트를 통과한 후 성공적인 광부가 되는 것을 목표로 하는 Minecraft 게임을 고안했습니다. Minecraft에서 금을 얻는 방법? 여러 단계를 거쳐 광부로 "작업"하고 채굴 된 광석을 주괴로 바꾼 다음 예를 들어 전투 갑옷을 만드는 데 사용해야합니다. 고대 성과 던전에서 원하는 금속을 찾을 수도 있고 어려운 레벨 통과 경로에서 만나는 사람들을 "주변에 물어보십시오". 실제 금 광부에게 이것은 공허한 재미처럼 보이지만 Minecraft 게임은 남극 대륙을 제외한 모든 대륙을 정복했으며 개발자에게 모든 광부가 부러워 할만큼 많은 돈을 가져 왔습니다.
물 속의 금은 신화가 아니라 확인이 필요하지 않은 현실입니다. D. I. Mendeleev 표의 79 번째 요소 이온은 인체에 존재하며 식물의 일부이며 물론 물입니다. 일반적인 액체는 귀금속이 풍부하고 금을 운반하며 강 바닥을 따라 입자를 운반하여 퇴적물을 형성합니다. 이 수질은 강과 하천을 열정적으로 탐험하는 전 세계 광부들에게 흥미로울 것입니다.
물에서 금 찾기
Au를 어디서 어떻게 찾을 수 있습니까?
금은 겨울과 여름 모두 물에서 채굴됩니다. 이 요소는 여러 가지 방법을 사용하여 찾을 수 있으며 추운 날씨는 숙련된 탐사자를 멈추지 않습니다. 우선, 물에서 귀금속을 추출하는 데 도움이 되는 행동 알고리즘을 연구할 가치가 있습니다.
따라서 Au를 찾고자 하는 사람들을 위해 해야 할 일:
- 지역을 탐색하고, 장소를 선택하고, 현지인들과 약간의 대화를 나누십시오. 추가 정보는 결코 불필요한 것이 아니므로 해당 지역을 주의 깊게 조사하고 지도를 보고 가능한 한 많은 정보를 수집하는 것이 좋습니다. 현지인들과의 대화는 Au가 발견된 곳과 얼마나 오래 전에 발견되었는지 확인하는 데 도움이 될 것입니다.
- 물 속의 금 함량은 유쾌하게 놀라고 심지어 기쁘게 할 수 있지만 그것을 찾으려면 물속에서 스쿠버 다이빙을해서는 안됩니다. 단순히 암석을 탐험하고, 큰 돌을 조사하고, 물 샘플을 채취할 수 있습니다.
- 쟁반을 사용하여 모래 샘플을 채취하거나 강둑이나 개울에서 석영 자갈이 있는지 검사해야 합니다. 석영은 금의 주요 동반자이지만 검색할 수 있을 뿐만 아니라 황철광과 은도 Au와 "동행"할 수 있습니다.
금을 얻는 방법과 귀금속 추출에 사용할 수 있는 장치:
- 물에는 Au 모래 입자가 포함되어 있지만 흐름과 함께 뜨지 않고 바닥을 따라 기어갑니다. 수년에 걸쳐 모래 알갱이가 압착되어 덩어리와 퇴적물로 변할 수 있습니다. 미니 준설선은 바닥에서 금속을 감지하는 데 도움이 됩니다. 이것은 진공 청소기처럼 작동하는 장치입니다. 미니 준설선은 모래를 빨아들여 Au 감지에 도움을 줍니다. 기계 자체가 금을 불순물과 먼지로부터 여과, 헹구고 분리합니다.
- 금속 탐지기는 강이나 개울에서 귀금속을 탐지하는 데 도움이 되는 또 다른 장치입니다. 장치를 물에 담그면 금에 반응하여 얕은 깊이에서 침전물을 감지할 수 있습니다. 금속 탐지기의 도움을 받아도 해안 지역을 탐험할 수 있습니다.
- 우리 조상들은 Au 트레이를 씻을 때 사용했습니다. 처음에는 양가죽으로 장치를 만들었고 나중에 기술이 변경되었습니다. 현대식 트레이는 산의 강, 빠르게 흐르는 개울에서 작업하는 데 사용됩니다. 그러나 진행 상황은 멈추지 않으며 현대식 트레이가 더 가볍고 편리하다는 사실에도 불구하고 주로 물 샘플 채취에 사용됩니다.
도구가 있으면 검색 속도를 높이고 성공 가능성을 높일 수 있습니다. 그러나 이것이 값 비싼 장비가 땅이나 물에서 덩어리를 감지하는 것을 100 % 보장한다는 것을 의미하지는 않습니다.
모래 속의 금
해안 모래에서 Au를 얻는 것은 샘플을 채취한다는 사실에서 시작됩니다. 그들은 단순히 노란색 금속 알갱이가 있는지 연구하면서 쟁반에서 씻습니다.
더 많은 모래를 파서 가방에 담그고 물을 부을 수 있습니다. 사실 모래는 금보다 훨씬 가볍습니다. 귀금속은 즉시 바닥에 가라 앉고 볼 수 있지만 모래알은 계속해서 가방에 떠 있습니다.

저수지에서 금의 가능한 위치 계획
모래가 든 물은 여과해야하며 필터로 사용할 수있는 것이 없으면 액체가 간단히 배수됩니다. 그녀는 모래와 함께 떠날 것이고 Au는 가방 바닥에 남을 것입니다.
귀금속은 여름에만 모래에서 채굴되며 겨울에는 탐사자가 단순히 해안 지역을 검색하고 돌을 조사하지만 모래를 씻지는 않습니다.
대부분의 경우 모래는 단순히 샘플링되며 강 바닥에서 들어 올리거나 해안 근처에서 파냅니다. 샘플은 선택한 위치에 Au가 있는지 여부와 이 위치에 Au가 얼마나 있는지 확인하는 데 도움이 됩니다. 하나 또는 두 개 이상의 금 알갱이를 찾으면 검색을 계속할 수 있습니다. 노란색 금속의 양이 미미하면 시커는 다른 곳으로 이동합니다.
덩어리를 찾을 수 있는 깊이는?
- 무게가 1g 이하인 금은 10-13cm의 모래 층 아래에서 가장 자주 발견되며 얻기가 그리 어렵지 않습니다.
- 흙을 15-30cm 높이면 1.5g이 넘는 덩어리를 찾을 수 있습니다.
- 모래 바로 뒤에 있는 땅을 파보면 100g이 넘는 귀금속 조각을 통째로 발견할 수 있다.
그러나 Au의 추출은 특정 어려움과 관련이 있으며 "발굴"이 성공적으로 끝날 것이라는 보장은 없습니다. 이러한 이유로 수색을 시작하기 전에 해당 지역을 조사하고 토양, 모래 및 물 샘플을 채취하는 것이 좋습니다.
바닷물에서 금 찾기
해수에서 귀금속을 추출하는 데는 몇 가지 어려움이 있습니다. 그들은 바다와 바다에서 모든 금을 추출하면 그 무게가 매우 괜찮을 것이라고 말합니다. 그러나 오늘날 바다와 바다의 물에서 Au를 추출하는 데 도움이 되는 효과적인 방법은 하나도 없습니다. 그러나 곧 과학자들이 이 문제에서 여전히 성공할 수 있을 것이라는 희망이 있습니다.
박테리아는 바닷물에서 금을 추출할 수 있습니다. 얼마 전까지만 해도 물 1조 입방미터당 몇 개의 금 입자가 있어도 미생물이 금속 입자를 감지할 수 있다는 사실이 밝혀졌습니다.
박테리아는 금속이온을 침전시켜 결합하는데 미생물에게는 일정한 시간이 필요하다.
이 추출 방법은 아직 연구 중이기 때문에 모든 전망에도 불구하고 효과적이라고 할 수는 없습니다.
원칙적으로 많은 국가의 전문가들은 오랫동안 바닷물에서 Au를 추출하는 방법에 대해 의아해했습니다. 몇 가지 방법이 있지만 모두 너무 비싸다고 간주되어 금광 산업에서 사용되지 않습니다.
이익과 관점
Au가 채굴되는 위치, 수중 또는 육지에 관계없이 금 채굴 산업은 이제 유망한 것으로 평가됩니다.
생산량은 지속적으로 증가하고 지질 학자들은 새로운 매장지를 찾고 있으며 기술 진보는 멈추지 않습니다. 다양한 종류의 장비의 발명은 이전에 포기되고 가능성이 없는 것으로 간주되었던 광상 개발을 다시 시작하는 데 도움이 됩니다.
귀금속은 암석층에 사람의 눈에 보이지 않게 숨겨져 있으며, 많은 양은 지구의 깊은 곳에 있습니다. 금은 화산 활동이 일어나는 곳에서만 표면에 나타납니다. 이 때문에 오랜 세월 동안 인류는 지구의 장에서 추출하는 방법뿐만 아니라 바닷물에서 귀금속을 추출하는 방법에 대해서도 고민해 왔습니다.
동시에, 수년 동안 옐로우 메탈에 대한 사람들의 사랑은 약해지지 않았습니다. 금은 매력적이고 매혹적이지만 외적인 아름다움만이 광부와 은행가를 매료시키는 것은 아닙니다.
귀금속은 수익성 있는 투자입니다. 시세는 지속적으로 증가하고 있으며 경제 위기 상황에서 금의 안정성은 많은 사람들을 매료시킵니다.
의심할 여지 없이 업계는 발전하고 있으며 Au 채굴은 수익성 있는 사업이 되고 있습니다. Metal은 대기업 직원뿐만 아니라 여행자, 광부 및 재정 문제를 해결하거나 약간의 재미를 원하는 평범한 사람들도 찾고 있습니다.
그러나 전문가 수준에서 금속을 검색하려면 재료 투자가 필요하다는 것을 잊지 마십시오. 장비를 획득하고 정보에 접근하고 금광을 발견하는 데 할애할 시간을 찾는 것이 필요합니다. 평균적으로 예금을 찾고 개발하는 데 최소 1년이 걸립니다.
현재 바닷물에 용해된 최소 60개의 원소가 알려져 있음에도 불구하고 산업적 규모로 추출되는 것은 4개뿐입니다. 이들은 나트륨, 염소(일반 식염), 마그네슘 및 그 일부 화합물과 브롬입니다. 일부 칼슘 및 칼륨 화합물은 식탁용 소금을 얻는 과정이나 마그네슘 추출 과정에서 부산물로 채굴됩니다. 일반적으로 이러한 제품은 해수에서 추출한 결과 또는 조류 처리 과정에서 칼슘과 칼륨을 농축하여 얻습니다. 그러나 해수에서 직접 이러한 원소를 산업적으로 추출하는 방법은 아직 마스터되지 않았다는 점에 유의해야 합니다. 바닷물에서 다른 광물 화합물을 추출하려는 수많은 시도가 있었지만 산업적 추출은 성공하지 못했습니다. 또한 해수에서 식염, 마그네슘 및 그 화합물, 브롬, 요오드, 칼륨, 황산칼슘, 금 및 은을 추출하는 많은 방법이 특허를 받았습니다(Baudin, 1916; Cernik, 1926; Niccali, 1925; S. O. Petterson, 1928; Vienne). , 1949).
소금 추출
바닷물에서 소금을 체계적으로 생산하는 것은 기원전 2200년보다 훨씬 일찍 중국에서 시작되었습니다. 이자형. 수세기 동안 많은 사람들이 소금 공급원으로 바다에 의존해 왔습니다(Armstrong and Miall, 1946). 그리고 현재 중국, 인도, 일본, 터키, 필리핀 등의 국가에서는 햇빛에 의해 단순 증발시켜 바닷물에서 추출한 소금이 전체 소금 소비량의 상당 부분을 차지하고 있습니다. 전 세계적으로 매년 약 600만 톤의 소금이 생산됩니다. 일반적으로 해수에서 증발하여 소금을 생산하려면 건조한 바람과 함께 더운 기후가 필요합니다. 그러나 바다와 더운 기후의 근접성 외에도 증발 분지 토양의 낮은 투수성, 해수면 아래에 있거나 바다에 침수된 광대한 저지대의 존재 등 여러 가지 조건이 충족되어야 합니다. 조수, 활성 증발 기간 동안의 낮은 강수량, 신선한 강물의 희석 효과 부재, 마지막으로 저렴한 소금 생산 비용과 관련하여 저렴한 차량의 가용성 또는 시장의 근접성.
미국에서 소비되는 모든 소금의 약 5%는 증발에 의해 생산되며, 주로 1852년에 이 어업이 시작된 샌프란시스코 베이 지역에서 발생합니다. 5는 San Francisco Bay의 남쪽 끝 근처에 있는 인공 증발 연못을 보여줍니다. 여기에 총면적은 약 80제곱미터다. 마일 "Leslie Salt Company"는 매년 약 120만 톤의 소금을 추출합니다. 비슷한 염전이 남부 캘리포니아의 뉴포트와 샌디에고 만의 상류에서도 발견됩니다. 연간 생산성은 100,000톤입니다(Emery, 1960). 샌프란시스코 베이 근처의 증발 웅덩이로 해수를 방출하는 것은 바다에서 웅덩이를 둘러싸는 댐의 수문을 통해 만조 기간 동안 수행됩니다. 바닷물의 상당 부분이 증발하고 그 안에 포함된 염분이 들어갈 때까지 이곳에서 바닷물을 숙성시킵니다.

쌀. 6. 기계적 스크레이퍼는 결정화된 소금의 최상층을 제거하는 데 사용됩니다. "소금 수확"이 발생할 때까지 소금층의 두께는 보통 4-6인치입니다.
황산칼슘은 첫 번째 용액 중 하나에서 결정화됩니다. 황산칼슘 염이 바닥에 침전된 후 남은 소금물은 증발로 인해 염화나트륨이 침전되기 시작할 때까지 용액이 더욱 두꺼워지는 정원 수영장으로 조심스럽게 옮겨집니다. 소금물의 증발은 약 1.28의 비중에 도달할 때까지, 즉 마그네슘 염의 적재가 시작될 때까지 계속됩니다. 이 단계의 소금물을 쓴 어머니 소금물이라고합니다. 소금물은 케이지 풀에서 제거되어 다양한 마그네슘 화합물, 브롬 및 기타 염을 얻는 다른 기업으로 운송됩니다. 소금물을 제거한 후 새 소금물을 케이지 풀에 다시 붓고 염화나트륨을 얻는 전체 주기를 반복합니다. 8월 1일까지 4~6인치 두께의 염화나트륨 층이 이러한 웅덩이 바닥에 축적됩니다. 기계식 스크레이퍼와 로더를 사용하여 소금을 샘플링합니다(그림 6). 그런 다음 소금은 바닷물로 다양한 불순물에서 씻어 내고 큰 원뿔 모양의 마운드 형태로 저장됩니다 (그림 7). 산업용 소금은 대부분 더 이상 정제되지 않습니다. 그러나 인구가 식품을 소비하는 경우 추가로 정제됩니다. 정제된 제품의 NaCl 함량은 99.9%를 초과합니다. 미국에서 태양의 영향으로 해수를 자유롭게 증발시켜 얻은 소금의 비용은 추출 장소 근처의 생 제품 1톤당 $10에서 정제 및 포장된 식탁용 소금 1톤당 $150에 이릅니다.

바닷물에서 소금을 추출하는 계획은 전 세계적으로 거의 동일하지만 많은 국가에서 저렴한 노동력으로이 과정을 수정할 수 있습니다.
스웨덴과 소련과 같이 기후가 다른 나라에서는 바닷물을 얼려서 소금을 얻습니다. 거의 순수한 물로 구성된 염수 얼음은 잔류 염수에서 여과되며, 잔류 염수의 농도가 충분히 높아져 인공적인 작용으로 증발 건조가 시작되기 전에 일련의 연속적인 동결 작업이 수행됩니다. 난방 (암스트롱, Miall, 1946) .
염화나트륨 분리 후 남은 농축 염수는 그 안에 존재하는 화합물을 추출하기 위해 추가 특수 처리를 거칩니다. 따라서 용액에 염화칼슘을 첨가하면 황산칼슘(석고)이 경화되어 판매됩니다. 소금물을 더 농축하면 마그네슘, 칼륨 및 기타 염의 황산염이 침전됩니다. 공정의 마지막 단계에서 잔류 용액에서 염화마그네슘과 브롬을 회수합니다.
해수에서 브롬 추출
브롬은 지각의 총 브롬 함량의 99%가 바다에 있기 때문에 거의 해양 원소로 간주될 수 있습니다(표 2 참조). 브롬은 1825년 프랑스 연구원 A. J. Balard가 몽펠리에 근처 염습지의 물에서 소금을 침전시킨 후 얻은 농축 용액에서 발견되었습니다. 보다 최근에는 Strasfurt의 칼륨 광상과 미시간, 오하이오 및 웨스트버지니아의 시추공에서 나오는 염수에서 브롬이 발견되었습니다. 브롬은 1926년 캘리포니아에서 인공 증발 연못에서 소금을 추출하는 동안 얻은 어머니 염수를 처리하는 동안 해수에서 처음 분리되었습니다. 산업계의 브롬 소비는 고압축 내연기관 생산 이전에 상대적으로 제한적이어서 시장 수요는 시추공 염수 및 염 침전물에서 추출한 양으로 충족되었습니다. 그러나 상황은 극적으로 변했습니다. Ethylenedibromide는 실린더 벽, 밸브, 피스톤 및 점화 플러그에 납 침전물을 방지하기 위해 테트라에틸 납 첨가제가 포함된 녹 방지 가솔린에 첨가되었습니다. 브롬에 대한 수요가 이렇게 증가함에 따라 시추공에서 펌핑되는 염수가 불충분한 것으로 판명되었습니다. 소금 생산에서 부산물로 브롬의 수요와 추출을 충족시키지 못했습니다. 다른 브롬 공급원이 시급히 필요했습니다.
추가 브롬 공급원에 대한 광범위한 검색에서 Ethyl Corporation은 미리 농축되지 않은 해수에서 직접 브롬을 침전시키는 공정을 개발했습니다. 이 방식에 따르면 브롬은 해수가 아닐린과 염소로 처리될 때 불용성 화합물인 트리브로모아닐린의 형태로 침전됩니다. 염소의 가수분해를 피하기 위해 해수는 먼저 황산으로 산성화됩니다. 나중에 이 프로세스는 산업 생산 규모로 확장되었습니다. 이 장치는 선박에 설치되어 브롬 회수 공장으로 개조되었습니다. 한 달에 25일 가동되는 이러한 부유식 플랜트는 약 75,000파운드의 브롬을 생산합니다. 같은 기간 동안 공장은 250톤의 농축 황산, 25톤의 아닐린, 66톤의 염소 등의 시약을 상부 및 하부 데크 사이에 저장합니다. 1톤당 0.1파운드만 함유된 해수에서 브롬을 추출하는 효율은 약 70%다. 선박은 공정 완료 후 배출되는 폐수로 해수가 희석되는 것을 방지하기 위한 보호 조치를 갖추고 있습니다. 나중에 많은 해안을 따라 존재하는 해안 해류가 혼합을 방지하는 데 성공적으로 사용될 수 있음이 밝혀졌습니다. 현재 기술적 인 관점에서 부유 식 플랜트에서 브롬을 추출하는 과정은 성공적으로 해결되었지만 높은 부식성 시약으로 공해에서 작업하는 것은 육상보다 훨씬 어렵습니다.
브롬 회수 플랜트 건설을 위한 부지 선택은 세심한 주의를 기울여야 합니다. 동시에 식물이 소비하는 해수를 강우, 하수 및 브롬이 이미 추출된 물로 희석할 가능성을 미리 배제할 필요가 있습니다. 또한 해수는 염도가 높고 일정하며 온도가 비교적 높아야 하며 염소를 낭비하는 유기성 폐기물로 오염되지 않아야 한다. 위의 요건을 모두 충족하는 그런 곳이 Cure Beach(North Carolina) 근처에서 발견되었습니다. 여기에 "Ethyl Dow Chemical Company"는 연간 3,000톤의 브롬을 처리할 수 있는 공장을 건설했습니다. 1938년에 이 기업의 용량은 연간 브롬 20,000톤으로 증가했습니다(Shigley, 1951).
이 유형의 또 다른 공장은 Cure Beach 근처보다 해수에서 브롬을 추출하는 조건이 모든 기술적 요구 사항에 더 적합한 Freeport 근처에 건설됩니다. 이 공장의 설계 용량은 연간 15,000톤의 브롬입니다. 1943년에 동일한 용량의 또 다른 공장이 그곳에 건설되었습니다. Cure Beach 근처의 기업은 2차 세계 대전이 끝날 때 문을 닫았습니다. 따라서 Freeport 공장은 현재 미국 연간 브롬 소비량의 약 80%를 생산하고 있습니다. 무화과. 도 8은 Ethyl Dow Chemical Company의 브롬 회수 공정의 다이어그램이다.

Cure Beach 공장에서는 이전에 개발된 기술에 따라 해수, 산 및 염소의 혼합물을 나무 격자가 내장된 벽돌 탑 꼭대기에 부었습니다. 해수에 용해된 브롬은 염소에 의해 상대적으로 휘발성인 원소 브롬으로 환원되었으며, 혼합물에 존재하는 산은 염소의 가수분해를 방지했습니다. 탑의 상부에서 브롬-해수 혼합물이 배출됨에 따라 공기는 아래에서 위로 분출되었습니다. 통과하는 공기는 해수에서 자유 브롬을 운반하여 소다회가 채워진 흡수탑으로 운반한 후 더 이상 브롬을 포함하지 않는 해수를 바다로 다시 배출했습니다. 브롬으로 포화된 소다회 용액을 황산으로 처리하여 브롬산나트륨과 브롬화물을 유리 브롬으로 전환시켰다. 그런 다음 혼합물을 증발 컬럼으로 펌핑하여 브롬을 증류하고 유리 또는 세라믹 용기로 재응축했습니다. 증류에 의한 브롬의 추가 정제는 궁극적으로 최대 99.7%의 브롬 함량을 가진 제품을 얻는 것을 가능하게 했습니다.
1937년에 이 과정은 다소 수정되었습니다. 따라서 브롬의 1차 증류 과정에서 이산화황과 공기를 담체로 사용하였다. 결과적으로 브롬은 브롬화 수소산 형태로 방출되어 후속 정제를 크게 향상시킬 수있었습니다. 두 공정 모두 브롬 회수 효율이 90% 이상이지만, 이산화황을 사용하여 해수에서 브롬을 직접 추출하는 공정은 현재 미국에서 거의 독점적으로 사용됩니다(Shigley, 1951).
바닷물에서 마그네슘 추출
마그네슘은 건축에 사용되는 금속 중 가장 가볍습니다. 비중은 1.74, 알루미늄은 2.70, 철은 7.87입니다. 이 금속은 차량 건설에 가장 널리 사용됩니다. 또한 마그네슘은 양극 및 음극 보호 코팅 시스템, 플래시 포토램프 및 기타 여러 기술 분야에서 알루미늄과 합금의 구성 요소로 사용됩니다. 1964년까지 마그네슘의 연간 세계 생산량은 약 150,000톤이었습니다.
바닷물에는 약 0.13%의 마그네슘이 포함되어 있습니다. 그리고 이 농도가 육지에서 채굴된 마그네슘 광석에서 발견되는 양의 1/300에 불과하다는 사실에도 불구하고 바닷물은 미국에서 이 금속의 주요 공급원입니다. 마그네슘은 영국에서 처음으로 해수에서 얻었지만(Armstrong, Miall, 1946) 해수에서 마그네슘을 추출한 최초의 대기업은 Ethyl Dow Chemical Company에 의해 1941년 초 Freeport 근처에 설립되었습니다. 그 때까지 미국의 마그네슘은 시추공 소금물과 마그네사이트 침전물에서 얻었습니다.

Freeport 근처에 공장을 건설하기 위한 부지 선택은 다음과 같은 매우 유리한 상황에 따라 결정되었습니다. 값싼 천연 가스를 사용할 수 있으므로 열과 전기를 생산하는 데 효율적으로 사용할 수 있습니다. 공장의 지리적 위치로 인해 폐수를 다시 멕시코만으로 배출할 수 있으며 소비된 해수를 희석할 가능성은 극히 미미합니다. 매우 저렴한 석회는 마그네슘 공장에서 불과 몇 마일 떨어진 멕시코만 바닥에서 채굴된 석회 껍질에서 얻을 수 있습니다. 무화과. 그림 9는 Freeport 근처의 공장에서 마그네슘을 추출하기 위한 공정 흐름도를 보여주며 이 공장의 섹션 중 하나가 그림에 나와 있습니다. 10.

쌀. 10. Freeport(Texac)의 Ethyl Dow Chemical Company에 있는 마그네슘 처리 공장의 일반적인 모습. 전경에는 염화 마그네슘의 침전을 가속화하기 위해 해수와 석회의 혼합물이 펌핑되는 Dorr 증점제가 보입니다.
해수는 멕시코만에 연결된 운하의 수중 수문을 통해 시간당 약 100만 갤런의 속도로 공장에 유입됩니다. 이러한 공급 시스템의 장점은 식물 영역의 지표수보다 낮은 수층의 염도가 훨씬 높다는 것입니다. 인공 수영장에서 물은 석회 우유로 지속적으로 처리됩니다 (석회는 굴 껍질을 소성하여 얻는다고 위에서 언급했습니다). 석회유와 마그네슘 화합물의 반응 결과 불용성 수산화마그네슘의 액체 미사 같은 침전물이 형성되고 침전 탱크로 펌핑됩니다. 퇴적물은 이 생산에서 소비되는 해수의 총 부피의 약 2%를 차지합니다. 즉, 이미 기술 프로세스의 첫 번째 단계에서 유용한 구성 요소의 100배 농축이 수행됩니다. 폐수는 공장에서 상당한 거리에 있는 멕시코 만으로 흐르는 브라소스 강으로 내려갑니다.
여과된 수산화마그네슘을 염산에 용해시킨다. 생성된 염화마그네슘 용액은 해수에서 포착된 염분을 부분적으로 제거하기 위해 증발에 의해 농축됩니다. 칼슘은 용액에 황산마그네슘을 가하여 불용성 황산염 또는 석고로 침전시킨 후 다시 여과하여 석고와 기타염류를 분리한 후 증발농축한다. 염화마그네슘의 농도가 약 50%에 도달하고 용액의 온도가 약 170°로 상승하면 미리 건조된 고체 MgCl 2 에 분무합니다. 용매는 즉시 증기로 변하고 염화마그네슘이 침전됩니다. 그런 다음 건조된 고체 침전물을 전해 챔버에 넣어 금속 마그네슘과 염소 가스로 분해합니다. 염소는 염산으로 변환되어 공정의 후속 사이클에서 성공적으로 사용됩니다. 금속 마그네슘은 전해실에서 퍼내어 잉곳으로 형성됩니다. 금속 함량은 99.8%를 초과합니다(Shigley, 1951).
미가공 1차 금속 마그네슘에 대한 미국의 전반적인 수요는 제2차 세계대전 이후 해수에서 생산함으로써 충족되었습니다. 전쟁 중에 미국 정부는 마그네슘 생산을 위한 원료로 마그네사이트, 백운석, 펌핑 염수 및 바닷물을 사용하는 여러 공장을 건설했습니다. 그러나 전쟁이 끝날 때까지 이들 공장 중 어느 것도 해수에서 마그네슘을 추출하는 기업과 경쟁할 수 없었습니다. 보증합니다. .
마그네슘 공장 건설을 위한 부지 선택은 해수에서 브롬을 받는 공장보다 덜 엄격한 요구 사항에 의해 결정됩니다. 그러나 브롬과 마그네슘이 함께 추출되는 경우는 예외입니다. 따라서 마그네슘을 추출하는 과정에서 바닷물의 온도는 그다지 중요하지 않으며 원료 소비는 덜 중요합니다. 브롬 추출에 사용됩니다. 공장 부지 선택의 편의성을 결정하는 가장 중요한 요소는 값싼 석회, 연료 및 전기 공급원의 근접성입니다. 바닷물에서 마그네슘을 추출하는 과정의 효율은 85-90%입니다. 그리고 현대 기술 능력으로 해수에서 마그네슘을 훨씬 더 완벽하게 추출할 수 있지만, 회수율이 90% 이상 증가하면 각 비율에 대한 자본 비용이 급격히 증가하는 것으로 추정되기 때문에 이는 경제적으로 실행 가능하지 않습니다. 증가하다.
이 공정의 고유한 장점 중 하나는 이러한 재료를 펌핑하여 생산 라인에 직접 공급하면 원자재 비용을 더욱 낮출 수 있다는 것입니다. 이러한 기계화된 공급을 통해 생산 공정을 대체로 연속적으로 만들고 자동 제어 장치를 설치할 수 있습니다. 또한, 이러한 유형의 식물의 긍정적인 특징은 소비되는 원료의 극도의 균일성입니다.
마그네슘 화합물
MgO, Mg(OH) 2 및 MgCl 2 형태의 마그네슘은 다양한 산업에서 널리 사용됩니다. 용해로 내부 코팅용 내화재, 의약품 생산 원료, 절연체, 비료, 레이온 및 종이 생산 등에 사용됩니다. 세계의 많은 기업들이 해수에서 마그네슘 화합물을 얻습니다. 특히 이것은 영국과 미국에서 일반적입니다. 처음으로 해수에서 마그네슘 화합물의 산업적 추출은 식염 생산의 잔류 소금물에서 부수 공정으로 수행되었습니다(Seaton, 1931; Manning 1936, 1938).

쌀. 11. Moss Landing(캘리포니아) 근처 "Kaiser Aluminium Eid Chemical" 회사의 마그네슘 공장에서의 공정 순서.
해수에서 마그네슘 화합물을 추출하는 과정의 계획은 그림에 나와 있습니다. 11. 이러한 기술 체계는 Moss Landing(캘리포니아) 근처의 Kaiser Aluminium and Chemical Corporation 기업에서 사용됩니다. 해수는 하소된 백운석과 혼합됩니다. 수산화마그네슘이 침전된 다음 대형 농축 탱크에 침전됩니다. 침강 후 수산화마그네슘을 회수하고 세척하여 가용성 불순물을 제거하고 여과하여 수분 함량을 약 50%로 줄입니다. 이렇게 얻어진 수산화마그네슘의 일부는 브리켓 형태의 균질화된 필터 케이크로 시판된다. 이 제품은 종이 및 마그네시아 단열재 제조에 사용됩니다. 필터에 남아 있는 침전물의 일부는 레이온, 고무, 절연 코팅, 내화 벽돌의 생산에 사용할 수 있는 다양한 등급의 MgO를 형성하기 위해 다시 하소됩니다. 무화과. 도 12는 카이저 마그네슘 화합물 공장을 보여준다.

쌀. 12. Moss Leiding(캘리포니아) 근처 해수 회사 "Kaiser Aluminium End Chemical"에서 마그네슘 추출 공장(항공기 사진).
미국에서는 부식성 소성 산화마그네슘 총 부피의 약 90%와 내화성 마그네시아의 약 50%가 해수 또는 우물에서 펌핑된 소금물에서 얻습니다.
바닷물에서 나오는 금
바닷물에서 금을 추출하는 방법을 개발하는 데 너무 많은 노력과 비용이 들었습니다. 이 점에서 다른 요소와 비교하기는 어렵습니다. 방법 및 장비 측면에서 해수에서 금을 추출하는 것과 관련된 문제에 대해 많은 특허가 발행되었습니다(Bardt, 1927; Baudin, 1916; Bauer, 1912; Cernik, 1926; Bitter, 1938; Stoces, 1925). 1866년 프랑스 과학 아카데미 회원 중 한 명이 바닷물에 미량의 금이 존재한다는 사실을 발견했습니다. 그리고 그 후인 1886년 영국해협 물속의 금 함유량이 물 1톤당 최대 65mg이라는 보고가 나왔다.
금세기 초에 Svante Arrhenius는 바닷물의 금 함량에 대한 이전 결정이 적어도 10배 이상 과장되었다고 지적했습니다. 그러나 그럼에도 불구하고 Arrhenius 자신의 계산에 따르면 바닷물의 최소 금 함량은 1 톤당 6mg 이상이며 이러한 계산에 따르면 약 80 억 톤의 금이 세계 해양에 포함되어 있습니다. 이 양의 금은 지구상의 모든 사람을 백만장자로 만들기에 충분합니다. 그러나 수많은 특허와 프로젝트에도 불구하고 해수에서 이 금속을 실질적으로 얻을 수 있는 양은 아직 얻지 못했습니다.
제1차 세계 대전이 끝날 무렵 뛰어난 독일 화학자이자 노벨상 수상자인 프리츠 하버 박사는 독일의 전쟁 부채는 바다에서 가져온 금으로 갚을 수 있다고 주장했습니다. 금의 농도가 해수 1톤당 5-10mg이라고 가정하고 Haber는 해양에서 가장 높은 금 함량을 연구하기 위해 적절한 인력과 장비를 갖춘 연구 선박을 배치했습니다. 그러나 Haber는 금의 농도가 물 1톤당 0.001mg을 거의 초과하지 않는다는 사실을 발견했습니다(Haber, 1927). 가장 높은 금 함량은 남대서양에서 나타나며 1톤당 0.044mg입니다. 열린 바다. 이 문제에 대해 10년 동안 연구한 후 Haber는 바닷물에서 금을 추출하는 것이 수익성이 없다는 결론에 도달했습니다. 해수에 있는 금에 대한 Haber의 값이 다소 부정확하다는 것이 이제 밝혀졌습니다. 왜냐하면 그가 분석 중에 사용한 화학 물질과 반응 용기에 있는 금의 존재를 분명히 고려하지 않았기 때문입니다.
해수에서 금을 추출하는 방법은 금과 친화력이 높은 황화물 입자를 사용하는 것입니다. 해수가 이러한 입자 위를 통과할 때 금은 황화물 표면에 달라붙는 것으로 여겨집니다. 또한 바닷물에서 금을 추출하는 재료로 수은도 제안된 바 있다.
바닷물에서 금을 추출하려는 많은 시도에도 불구하고, 이 금속을 유형의 양으로 얻은 사례는 단 한 건뿐입니다. Ethyl Dow Chemical Company는 노스캐롤라이나에 있는 브롬 회수 공장의 광범위한 작업과 관련하여 금을 포함한 다른 금속의 추출을 조사하고 있었습니다. 15톤의 바닷물을 처리한 결과 약 $0.0001의 가치인 0.09mg의 금을 추출할 수 있었는데, 오늘날 이 미미한 양은 바닷물에서 추출한 모든 금이다(Terry, 1964) ).
해수에서 추출한 기타 물질
일반적인 소금, 브롬, 마그네슘 및 그 화합물 외에도 때때로 해수에서 여러 가지 다른 물질이 추출됩니다. 그들은 일반적으로 소금 생산의 부산물이거나 특정 식물이나 물고기의 중간 매개를 통해 얻습니다.
처음으로 요오드는 1811년 초석 공장 소유주인 프랑스인 Bernard Courtois에 의해 조류의 재에서 발견되었습니다. 알칼리 생산에 적합한 원료를 찾기 위해 그는 이 목적을 위해 조류를 사용하기로 결정했습니다. 뜨거운 농축 황산이 들어있는 반응 용기를 청소하면서 그는 조류 재에서 보라색 연기가 방출되는 것에 주목했습니다. 어두운 금속과 같은 결정의 형태로 용기의 더 차가운 부분의 벽에 응축된 증기(Armstrong and Miall, 1946). 일부 조류, 특히 Laminaria의 요오드 함량은 공기 건조 기준으로 약 0.5%인 것으로 밝혀졌습니다. 바닷물의 요오드 농도는 약 0.05mg/l 또는 약 0.000005%입니다. 따라서 이러한 유형의 조류에서 요오드 농도는 바닷물의 함량과 비교하여 100,000배 발생합니다.
Courtois의 발견 직후, 의학에서 요오드의 중요성이 확립되었습니다. 해조류에서 요오드를 추출하기 위해 주로 북부 잉글랜드에서 산업의 집중적 인 개발이 시작되었습니다. 1846년 글래스고에는 해초에서 요오드를 추출하는 공장이 12개 이상 있었습니다. 그러나 칠레의 질산염 광상에서 요오드가 발견되면서 해조류 요오드 생산량이 감소했습니다.
같은 시기에 상당한 양의 칼륨과 나트륨 염이 해조류에서 추출되었습니다. 본질적으로 이 프로세스의 기술은 개발되지 않았습니다. 물로 조류를 간단히 침출시킨 후 생성된 용액을 증발시키는 것이 보통 수행되었다. 소금을 생산하는 또 다른 매우 일반적인 방법은 조류를 태우고 재를 물로 침출하는 것입니다. 이러한 원시적 과정의 결과로 요오드는 요오드화 칼륨 또는 요오드화 나트륨의 형태로 얻어졌으며 황산 및 이산화망간과 혼합될 때 요오드 원소로 환원되었습니다.
조류 사용의 역사에는 세 가지 다른 기간이 있습니다. a) 첫 번째 - 조류가 알칼리 생산을 위한 원료로 사용되었을 때, b) 두 번째 - 요오드 추출에 사용되었을 때, c) 셋째 - 조류에서 칼륨을 추출했을 때. 그러나 각각의 기간은 육지에서 채굴된 값싼 원자재에서 이러한 제품을 얻기 위한 보다 진보된 방법의 생성으로 끝났습니다. 현재 조류는 식품 생산에서 젤라틴 형성 및 유화제로 사용되는 유기 화합물인 알긴산나트륨 생산의 원료로 사용된다. 문제의 화합물 생산을 위한 원료로 해조류를 가공하는 대기업은 남부 캘리포니아 해안에 위치하고 있습니다. 세계의 많은 지역, 특히 동양에서는 조류가 식품으로 널리 사용됩니다. 일부 해안 국가에서는 비료로 사용됩니다.
해수담수화 시 광물화합물의 추출
최근 해수담수화 문제에 특별한 관심이 집중되고 있다. 일반적으로 이 경우 폐수 내 염분 농도는 원래 해수 내 이러한 염분 함량보다 몇 배 더 높습니다. 이러한 소금물에서 미네랄 화합물을 추출하는 작업 과정에서 매우 고무적인 결과를 얻었습니다. 이는 상대적으로 염수 온도가 높고 농도가 약 4배 더 높은 가공 공장으로 들어가는 물을 양수하는 비용의 감소를 의미합니다.
해수 담수화 공정이 비용 효율적인 것으로 판명되면 폐수에서 회수할 수 있는 광물 화합물의 양이 예상 수요보다 몇 배 더 많아질 것입니다. 예를 들어, 향후 수십 년 동안 해안 지역의 인구가 약 1억 명에 달할 것이며, 이들은 연간 1인당 평균 10만 갤런의 물을 가정용 및 산업용으로 사용할 것이라고 가정합니다. 이 소비율은 결국 약 1013갤런 또는 10입방미터의 값에 도달할 수 있습니다. 연간 물의 마일. 바다에서 이 양의 물을 받아 25%의 담수 추출 효율로 염화나트륨 64억 톤, 마그네슘 2억 4천만 톤, 유황 1억 6천만 톤, 붕소 80만 톤, 2천 톤 알루미늄 400톤, 망간 400톤, 구리 560톤, 우라늄 560톤, 몰리브덴 2,000톤, 은 40톤, 금 약 1톤. 우리는 이러한 양의 10%만 추출하는 것이 경제적으로 수익성이 있고 해수 담수화를 수행한 인구가 이러한 광물 성분을 소비할 수 있다고 가정합니다. 그런 다음 표에 있는 통계 데이터를 기반으로 합니다. 3, 우리는 몰리브덴, 붕소 및 브롬의 추출 속도가 소비량에 해당하는 반면 다른 광물 화합물의 생산은 이러한 물질에 대한 수요를 크게 초과할 것이라는 결론을 내릴 수 있습니다. 물론 모든 소금을 추출할 필요는 없습니다. 판매되는 소금만 구입하는 것이 좋습니다. 어쨌든 기술적 어려움으로 인해 해수 농도가 붕소 농도보다 낮은 원소의 산업적 추출은 현재 불가능할 것입니다. 그러나 다음 고려 사항에 주의해야 합니다. 해수에서 우라늄과 토륨을 추출하는 것이 가능하다면 증식형 원자로에서 이러한 요소를 사용하면 담수 생산을 위한 전환 플랜트 운영에 필요한 열 에너지를 제공할 수 있습니다.
| 요소 | 연간 제품, t |
1인당 생산량 일반 인구 그 힘 10 8 사람, t/년 |
현대의 소비 미국에서 1인당 인구, t/년 |
태도 생산 소비에 |
| NaCl | 64*10 8 | 64 | 0,145 | 440 |
| 마그네슘 | 2,4*10 8 | 2,4 | 25*10 -4 | 10000 |
| 황 | 1,6*10 8 | 1,6 | 0,033 | 50 |
| 칼륨 | 68*10 6 | 0,68 | 0,010 | 68 |
| 브롬 | 1,2*10 6 | 0,012 | 4,7*10 -4 | 25 |
| 보르 | 0,8*10 6 | 0,008 | 5,5*10 -4 | 15 |
| 알류미늄 | 2000 | 2*10 -5 | 0,013 | 0,001 |
| 망간 | 400 | 4*10 -6 | 0,0033 | 0,001 |
| 구리 | 560 | 7*10 -6 | 0,0067 | 0,001 |
| 천왕성 | 560 | 5*10 -6 | 1,4*10 -4 | 0,04 |
| 몰리브덴 | 2000 | 2*10 -5 | 8,3*10 -5 | 24 |
| 은 | 40 | 6*10 -7 | 3,0*10 -5 | 0,02 |
| 니켈 | 400 | 4*10 -6 | 0,001 | 0,004 |
| 금 | 1 | 2*10 -9 | 5,0*10 -6 | 0,0004 |
이제 대형 원자로는 전환 담수화 플랜트에 열 및 전력을 제공할 수 있도록 설계되었습니다(Hammond, 1962) 담수 생산 비용은 1000갤런당 약 $0.15로 추정되며, 이는 도시 지역에서 또는 일부 지역에서 관개 목적으로. 대형 원자로 플랜트는 매일 약 109갤런의 담수를 생산할 수 있습니다. 이 양은 인구 400만 명의 도시의 국내 및 경제적 필요를 충족하거나 500제곱미터 면적의 농작물을 관개하기에 충분해야 합니다. 마일. 그러나 이러한 식물이 향후 수십 년 내에 중요한 담수 공급원이 될 것이라고 기대하기는 어렵습니다. 해수의 광물 성분의 미래 소비와 가격 및 기타 비용의 변화 특성에 대한 가정도 충분히 입증되지 않았습니다. 즉, 통계 계산은 표에 배치됩니다. 3은 이론적인 가치만 있습니다.
N. V. Pertsov, 3. P. Ulberg, L. G. Iarochko, P. I. Gvoedyak, S 3 1 u4M lYa
"F Tumansky (7l) 지원자
콜로이드 화학 및 물 화학 연구소(5Y) 물에서 금을 추출하는 방법
본 발명은 콜로이드 화학에 관한 것으로, 금광 및 보석 산업 및 기타 비철 야금 기업에서 미세하게 분산된 금을 포함하여 현탁 고형물로부터 수성 분산액 및 폐수를 정화하는 데 사용할 수 있습니다.
박테리아의 도움으로 암석에서 금을 추출하는 알려진 방법이 있는데, 이는 그들이 금을 용액으로 옮기고 이온 교환 방법 O)에 의해 제거된다는 사실로 구성됩니다.
그러나 미생물은 암석 입자에 포함된 금을 추출하고 동시에 그 표면에서 배양하며 후자의 부재로 예를 들어 용액에서 콜로이드 금을 추출하는 데 사용하는 것은 효과를 가져오지 않습니다. 매우 희석된 용액에 대한 방법을 사용할 수 없음. 이 방법은 또한 매우 구체적이고 복잡하며 길다.
또한 금속 이온 또는 금속 화합물을 이온 형태로 고정하는 공정을 기반으로 하는 이온 교환 컬럼을 통해 이를 여과하는 것으로 구성된 폐수 및 세척수 처리 방법이 알려져 있습니다. 예를 들어 금, 이온 입자 입자(2).
그러나 이것은 고도로 분산된 금속 입자를 보유하지 않습니다. 금, 분산액은 200-300A입니다. 농도가 0.03r/ë(디시아누레이트 형태)인 이온 상태의 금과 콜로이드 금 0.03g/l을 함유하는 용액을 이온 교환기를 통과할 때, 이온 상태의 금은 0.001g/l 미만으로 남고, 콜로이드 금의 함량은 10-12F로 변경됩니다. 세탁 중
3 보석 공장 및 기타 산업의 폐수는 최대
기존 방법으로는 제거할 수 없는 콜로이드 금 15mg/l. 이온 교환 기술은 상당한 양의 염, 산 및 알칼리뿐만 아니라 완제품인 순수한 물의 소비와 관련된 재생 단계의 필요성을 제공합니다. 콜로이드 금의 추출 비율은 10-143이며 이온
본 발명의 목적은 물에서 금 추출 정도를 높이는 것이다.
이 목표는 효모, Saccharomyces 또는 Candida 속을 콜로이드 상태의 금을 함유한 물에 도입함으로써 달성됩니다. 또는 Rodotoru1a, 또는 Escher i chia 박테리아, 혼합물을 바람직하게는 5-45분 동안 유지하고, 분산상을 분리하고 금을 회수한다. 미생물은 금 1 mg/ml당 106-10 cells/ml의 양으로 도입하는 것이 바람직하다.
이 방법은 다음과 같은 방식으로 수행됩니다. 30
널리 알려지고 사용되는 미생물 기술의 배양액이 사용됩니다 - 효모 Sa ccha romyces 또는 Candida 또는 Rodotorula 또는
11에서 Escherichia.
효모 배양은 하루 동안 맥아 즙 한천과 박테리아-고기 펩톤 한천에서 식염수로 씻어냅니다 (10 4 mol / l NaC
b" 8 FZK-56 네펠로미터 큐벳 3.055에서 광 필터 6을 농도 0.030.24 mg/ml의 금 수용액에 도입하고,
5-45분 후 분산상은 원심분리 또는 전기보류에 의해 분리되고 금은 예를 들어 생성된 덩어리를 태워 회수됩니다. 금 함량은 에 의해 결정됩니다. 교정 곡선을 사용하는 UV 분광 광도계.
최적의 시간은 미생물의 종류에 따라 다릅니다.
30분, 대장균의 경우
대장균 - 45분, 또한 미생물이 금과 응집하는 능력은 배양 기간에 따라 다릅니다. ° 예를 들어, 4일 배양의 경우 2일 배양에 비해 필요한 접촉 시간이 증가합니다.
실시예 1. 농도가 있는 콜로이드 금을 함유하는 보석 공장에서 나오는 폐수 50ml에
0.03 mg/ml에 3 ° 10 세포/ml 농도의 Saccharomyces vini 배양 현탁액 50 ml를 첨가합니다. 접촉시간 30분 생성된 덩어리를 5분 동안 원심분리합니다.
5000rpm, 물 분리. 후자의 금 함량은
0.001mg/ml. 동시에 그들은 추출
1.40kg의 금.
실시예 2. 0.24mg/ml의 콜로이드 금을 함유하는 50ml의 수분산액에 3.108 세포/ml 농도의 Saccharomyces vlni 배양 현탁액 50ml를 첨가하고, 접촉 시간은 45분이다. 중앙 작업 챔버와 작업 셀로판 멤브레인에서 분리된 두 개의 전극 챔버로 구성된 전기 유지 셀을 통과했습니다.
세포의 중앙 챔버는 과립형 실리카겔로 채워져 있습니다. 작업 챔버에서 1.5ml/min의 유속으로 50V/cm의 강도로 전기장을 생성합니다. 에 따르면
UV 분광광도계는 완전한 추출(실리카 겔에 보유) 분산된 금입니다. 이 표는 제안되고 알려진 방법으로 물에서 금을 추출하는 정도에 대한 비교 데이터를 제공합니다.
이 방법을 사용하면 수용액과 폐수에서 고도로 분산된 금을 거의 완전히(98-993까지) 추출할 수 있습니다.
하나의 보석 섬유에만 제안된 방법을 사용하면 50-60,000 루블의 예상 경제 효과를 얻을 수 있습니다. 연간, 948897
S C5 a c5 b-o
I5 x bx o x
С1 약 약 약.
수 cd cd o o o
° ° m m a s i
U o c () x c co c
LA sch o o o o o
° ° o o a o
SL CA o o o bb \ SS \ o o o o o
오 오 오 오 오
G. Lebedeva 작성
편집자 M. Tovtin Tekhred M. Nagy 교정자 G. Reshetnik
주문 5688/1
순환 981 서명됨
발명 및 발견을 위한 소련 국가 위원회의 VNIIPI
113035, 모스크바, N-35, Raushskaya nab., PPP "Patent"의 4/5 지점, Uzhgorod, st. 디자인, 4
본 발명의 제제는 금 1 mg/ml당 10 10 세포/ml의 양으로 물에 도입된다.
1. 물에서 금을 추출하는 방법 - 3. 단락에 따른 방법. 1 및 2, 뚜껑으로부터, 미생물에 의한 추출 정도를 증가시키기 위해, 물이 흐름에 유지되고, 먼저 물에 도입되는 것을 특징으로 하는, 우리는 5-45분. Saccharomyces 속의 효모 또는 Can- 정보 소스, dida 또는 Rodotorula 또는 검사에서 고려된 박테리아
금속 형태의 바닷물에서 금을 추출하기 위한 아말감 공정 및 장치는 일찍이 1903년에 제안되었습니다.
미리 여과된 해수는 튜브를 통해 수은이 들어 있는 원추형 깔때기 모양의 용기 바닥으로 펌핑되고 구멍이 뚫린 시트로 여러 섹션으로 나뉩니다(그림 92). 수은과 접촉한 후 상승하는 물의 흐름은 그물망을 통과하여 미세한 부석 수은을 포획한 다음 천공된 접촉 시트를 통과하고 마지막으로 장치 상단에 위치한 융합 수은을 통해 완전히 융합되도록 설계되었습니다. 흐름에서 금. 아말감은 통상적인 방법(압착, 스트리핑 및 용융)으로 가공되었습니다.
유사한 장치가 Ritter1에 의해 제안되었으며 그리드를 우회한 미세한 수은과 그 안에 포함된 금이 주름진 장치에 포획된다는 점에서 다릅니다.
이온 부유
위에서 언급한 바와 같이(IV장 참조), 이온 부유는 중금속 이온, 특히 금과 상호 작용하여 부유할 수 있는 불용성 화합물을 형성하는 일부 헤테로극성 화합물의 능력을 기반으로 합니다. 이 방향에서 가장 잘 알려진 작업은 Sebba(남아프리카) 189 J의 바닷물과 관련된 작업입니다.
수착
해수에서 금을 추출하기 위한 최초의 흡착제 중 하나는 탄소질 물질로 테스트되었습니다. 따라서 20세기 초에 Parker는 아스팔트, 역청, 미네랄 타르 등과 같은 점성이 있는 탄소 함유 물질이 자유 금에 친화력이 있음을 발견했습니다. 이를 바탕으로 Parker는 스트림에 설치된 바 및 스트립에 퇴적된 고체, 점성 탄소 함유 베드에 선택적으로 고정하여 해수에서 미세하게 분산된(또는 소위 부유하는) 금을 포획할 것을 제안했습니다. 담수와 점성 물질의 지속적인 접촉을 보장하는 것은 바다의 조수의 작용에 의해 수행되어야 합니다.
그러나 대부분의 연구자들은 탄소 함유 흡착제 중에서 활성탄이 해수에서 금을 흡착하는 데 가장 흥미로운 것으로 생각합니다.
이 방향의 선구자 인 독일 연구원 Nagel과 Baur (1912-1913)는 바닷물에서 금을 흡착하기 위해 코크스, 숯, 동물 숯 및 기타 흡착제를 사용할 것을 제안했습니다. 실험에서 모래 필터(현탁 물질 및 젤라틴 미생물 제거용)를 사용하여 예비 정화 후 해수는 자유 여과 또는 상승 여과 방법을 사용하여 코크스, 석탄 또는 기타 탄소 함유 물질의 필터 베드를 통과했습니다(그림 1). 93). 풍부한 흡착제를 주기적으로 제거하고 녹였습니다.
해수를 펌핑하는 비용을 줄이기 위해 선상에 흡착제 베드가있는 천공 용기 또는 바닥이 거짓이고 조석 작용으로 채워진 와이어 또는 패브릭 메쉬로 덮인 흡착제 층이있는 해안 통을 사용하는 것이 좋습니다.
동시에 고전적인 흡착제(활성 탄소)를 사용하여 새로 침전된 수산화물(알루미늄, 철, 실리카겔), 응고된 하이드로셀룰로오스 등과 같이 고도로 발달된 표면을 가진 무기 흡착제로 연구가 수행되었습니다. 무기 흡착제로 채워지고 섬유 섬유 재료의 이중층으로 완전히 덮인 해안 통 또는 특수 컵 받침을 사용하도록 제안되었습니다. 코스터는 몇 주, 때로는 몇 달 동안 바닷물에 담근 후 흡착된 금을 추출하기 위해 시안화물 용액으로 처리됩니다. 금도금 코스터는 반복적으로 사용됩니다.
가능한 수착 방법에 대한 연구에서 콜로이드 금 금속이 이 공정에서 추출되는 것이 바람직하다는 것이 밝혀졌습니다. 따라서 할로겐 금을 금속 상태로 환원시키는 동시에 새로 형성된 활성 표면을 생성하는 흡착제를 찾는 것은 자연스러운 일이었습니다. 가능한 다양한 흡착제를 조사한 Parker는 해수에서 금을 가장 완벽하게 추출하려면 황산제일철이 바람직하며 최적 소비량은 물 1톤당 2kg이라는 결론에 도달했습니다.
그 후 Parker는 아황산제일철을 사용한 흡착 방법의 하드웨어 설계에 대해 별도의 특허2를 받았습니다.
할로겐화물의 환원과 콜로이드 금의 흡착 과정의 조합은 다른 연구자들의 제안에서도 관찰됩니다. 그래서 Bardt는 해수를 환원제로 아황산염액(셀룰로오스 생산의 폐기물)으로 처리한 다음 미세하게 분쇄된 석탄과 분쇄된 금속(예: 구리, 철 등)의 혼합물과 혼합할 것을 권장했습니다. 귀금속을 함유한 침전물을 먼저 연소(탄소를 제거하기 위해)한 다음 제련하여 동반 금속에서 금을 수집했습니다.
Glazunov와 동료들(Paris, 1928)은 유사한 목표(할라이드 회수 및 콜로이드 금의 완전한 포획)를 추구하여 해수에 용해된 금의 흡착제로서 황화물, 특히 황철석을 사용할 것을 제안했습니다.
이 아이디어는 1953년에야 자신의 독창적인 길을 간 Walthers와 Stillman에 의해 실질적으로 실현되었습니다. 그들의 제안에 따르면 황화물 광석은 낮은 조수선 근처에 세워진 콘크리트 벽 뒤에 쌓여 해안을 향해 휘어졌습니다. 만조 때는 광석에 물이 넘쳤고 간조 때는 광석을 통해 물이 스며들었습니다. 이 주기는 여러 번 반복되었습니다. 일정 시간이 지난 후 금이 흡착된 분해된 황화물 슬러리를 썰물 때 제거하여 녹였다. 본 발명자들은 황화물에 의한 금의 침전이 해수가 방사성 원소에 노출됨으로써 촉진된다는 점에 주목하였다.
나중에 Stokes는 다양한 천연 및 인공 황화물 물질이 해수에서 금을 침전시키는 데 사용될 수 있으며 황화안티몬이 매우 효과적이라는 것을 보여주었습니다.
황화물에 의한 금 흡착 과정을 강화하는 동시에 해수를 펌핑하는 비용을 없애기 위해 Gernick과 Stokes는 문헌에서 "안티몬-황화물 트랩"이라고하는 특수 장치 d를 제안했습니다. 안티몬 황화물) 또는 "조력 에너지 시스템". 이 장치는 역 U자형 파이프의 형태로 만들어지며 한쪽 무릎에는 확장부가 제공되며 그리드 사이에 흡착제(활성 탄소 또는 황화물)가 배치됩니다. 해수는 조류의 영향으로 또는 기술된 장치가 부착된 선박의 이동 중에 이 튜브를 통해 흐릅니다.
지난 10-15년 동안 금속 황화물 2를 사용하여 해수에서 금의 흡착 추출을 개선하는 많은 특허가 나타났습니다. 이 방향에서 가장 독창적인 아이디어와 장비는 미국 연구원 Norris 3에 의해 제시되었습니다.
그의 최신 발명품은 강한 유기, 합성 또는 천연 섬유의 표면에 흡착된 갓 증착된 금속 황화물 콜로이드의 사용을 기반으로 합니다. 합성된 유기 섬유의 전형적인 예는 중합된 아크릴로니트릴 또는 비닐 시안화물 섬유입니다. 천연 섬유 중에서는 모시(猫皮) 섬유가 가장 적합하다. 이러한 섬유는 얇은 콜로이드 현탁액(예: 약 6.0의 pH 값에서 염화아연과 황화나트륨의 희석 용액을 혼합하여 준비한 갓 침전된 황화아연)에 침지된 경우 콜로이드 황화물 입자의 상당 부분을 능동적으로 흡착합니다. 그리고 그들의 표면에 단단히 유지하십시오.
이러한 방식으로 준비된 수착 섬유가 불량한 금 함유 용액(예: 해수)과 접촉하면 귀금속 이온이 흡착됩니다. 소량의 과산화수소를 첨가한 시안화나트륨의 가열 희석 용액 또는 염산을 소량 첨가한 차아염소산나트륨으로 처리하여 섬유에서 제거할 수 있습니다. 흡착된 이온이 용출된 후 섬유는 황화아연 슬러리로 전처리한 후 여러 번 세척하고 재사용할 수 있습니다. 황화아연 외에도 철, 망간, 구리, 니켈 및 황화납을 이 공정에 사용할 수 있습니다.
Norris의 장기 연구에 따르면 대부분의 해수에 종종 용해되는 특정 산화 가스가 사용되는 수집기 및 흡착 섬유에 악영향을 미칠 수 있습니다. 이러한 가스에는 산소, 질소 및 이산화탄소가 포함됩니다. 따라서 가장 큰 효과를 얻기 위해서는 제안된 장치가 섬유의 집적 구조와 접촉하기 전에 흐르는 해수에서 이러한 가스를 지속적으로 제거할 수 있는 수단이 있어야 합니다. 하나의 정상적인 작업으로 수집되고 섬유 덩어리를 처리하고 취급하는 복잡성뿐만 아니라 모든 작업을 연속적이고 자동으로 수행하는 것이 바람직합니다. 이러한 모든 요소는 Norris가 제안한 장치에서 고려되었습니다(그림 94).
연구자들에게 특히 흥미로운 것은 해수에서 금과 은을 추출하기 위해 천연 및 인공 이온 교환기를 사용하는 것입니다.
이 방향의 우선 순위는 1953년 바닷물에서 은을 추출하기 위해 철과 망간 제올라이트를 사용할 것을 제안한 Brook에게 있습니다.
이후 1964년 바이엘과 동료(독일)는 해수에서 귀금속을 100%까지 추출할 수 있는 소위 킬레이트 이온 교환 수지를 개발했습니다.
바닷물에서 금을 추출하기 위해 고체 이온 교환기를 사용하는 가장 최근의 작업 중에서 Gouffa Research and Development Company(USA)의 실험 그룹에 대한 연구가 가장 흥미로웠습니다.
귀금속 수집을 위해 매달린 카르복실레이트 또는 아미드 그룹을 포함하는 수불용성 에틸렌 폴리머를 사용하는 것이 제안됩니다. 이 폴리머를 얻는 가장 좋은 방법 중 하나는 에틸렌 알킬 아크릴레이트 코폴리머를 비누화하거나 에틸렌과 말레산, 푸마르산 및 타코닉산을 포함한 산성 그룹의 에스테르의 코폴리머를 합성하는 것입니다. 이러한 흡착제의 제조는 특허에 상세히 기술되어 있다.
폴리머 필름의 로딩 정도에 도달하면 흡착된 금은 폴리머를 태운 후 재에서 용융하여 추출하거나 가성 소다(가성 소다)에 폴리머를 용해하여 용액에서 침전시킬 수 있습니다.
자연 및 인공 이온 교환기를 사용하는 방법은 기본적으로 위에서 논의한 흡착제와 동일합니다.
Murro는 인공 이온 교환기를 사용하는 완전히 새로운 방법을 제안했습니다. 이를 상업 항해를 하는 선박의 선체에 적용하는 것입니다. 목적지 항구에 도착하면 이온 교환 수지는 선박에서 벗겨져 처리될 수 있습니다. 수지 처리는 산과 특수 원소로 세척한 다음 귀금속을 함유한 용출액을 전기분해하는 것입니다. 재생된 수지는 반복적으로 사용할 수 있습니다.
가장 경제적인 제안은 용기의 화물창에 위치하고 이온 교환 수지로 채워진 특수 장치를 사용하는 것입니다. 여기에서 선박의 전진 이동으로 인해 해수가 이온 교환기가 있는 선박을 통해 지속적으로 흐르게 되는 것으로 예상됩니다. 이 용기의 단면적은 약 9.5-10m2, 길이는 3m, 약 28m3의 수지를 포함해야 합니다. 수지에 흡수될 때 해수의 최대 유속은 분당 표면 1m2에서 -0.8m3(0.8m/min)이어야 합니다.
이러한 유속으로 하루에 약 12,500톤의 바닷물이 수착 장치를 통과하게 됩니다. 물에 담가두어도
하루에 1 mg!t의 금은 12.5 g의 금을 추출합니다. 1년 동안 지속적으로 수영하는 동안 약 5,000달러 상당의 약 4.5kg의 금을 흡수할 수 있습니다.
시멘트 결합
해수에서 금을 접합하는 방법의 실제 적용에 대한 몇 안 되는 보고서 중 하나는 미국 특허인 Parker 방법을 언급합니다. 니켈 분진은 접합 금속으로 제안됩니다. 환원, 치환 및 흡착을 통해 할로겐 및 원소 형태로 존재하는 해수에서 금을 분리할 수 있습니다.
니켈 분말과 해수를 혼합하여 침탄을 수행할 때 15~20중량%의 금 적재를 달성할 수 있습니다. 적재된 니켈 분말은 통에서 꺼내어 녹입니다.
매우 열악한 바닷물에서 금을 침전시키기 위해 Sneming은 텔루륨에 대한 금의 증가된 친화력을 사용할 것을 제안했습니다. 고도로 발달된 반응 표면을 갖는 무정형 텔루륨으로 증착을 수행하는 것이 가장 적절하다는 것이 입증되었습니다. 이러한 교착제는 가용성 텔루륨염을 이산화황으로 처리하여 얻습니다. 해수는 비정질 텔루르의 고정층을 통해 여과됩니다. 침전된 금을 추출하기 위해 농축된 덩어리를 가열하여 텔루륨을 승화(이후 포획)하고 나머지는 금으로 녹입니다.